
【题目】(1)在标准状况下①6.72L CH4 ②3.01×1023个HCl分子③ 13.6g H2S ④0.2mol NH3, 下列对这四种气体的关系从大到小表达正确的是_________
a.体积②>①>③>④ b.密度②>③>④>①
c.质量②>①>③>④ d.氢原子个数①>③>④>②
(2)在标准状况下,CO和CO2的混合气体共39.2 L,质量为61 g。则其中CO2为____________mol, CO的体积百分数为__________(保留一位小数),混合气体的摩尔质量为_______________(保留一位小数)。
(3)某混合气体中各气体的质量分数为:O2 32%,N2 28%,CO2 22%,CH4 16%,H2 2%,则此混合气体的平均摩尔质量为_____________(保留两位小数)。
【答案】bd 0.75 57.1% 34.9g/mol 22.22g/mol
【解析】
(1)根据n=![]() =
=![]() =
=![]() 计算各物质的物质的量;
计算各物质的物质的量;
(2)根据n=![]() 计算混合气体物质的量总和,设CO和CO2的物质的量分别为x mol、y mol,根据二者总质量、总物质的量列方程计算各自物质的量,气体的体积分数等于物质的量分数,根据M平=
计算混合气体物质的量总和,设CO和CO2的物质的量分别为x mol、y mol,根据二者总质量、总物质的量列方程计算各自物质的量,气体的体积分数等于物质的量分数,根据M平=![]() 计算混合气体的摩尔质量;
计算混合气体的摩尔质量;
(3)设气体总质量为100g,根据质量分数计算各自质量,再根据n=![]() 计算各自物质的量,根据M=
计算各自物质的量,根据M=![]() 计算混合气体的平均摩尔质量。
计算混合气体的平均摩尔质量。
(1)①6.72LCH4物质的量为![]() =0.3mol,②3.01×1023个HCl分子的物质的量为0.5mol,③13.6gH2S的物质的量为
=0.3mol,②3.01×1023个HCl分子的物质的量为0.5mol,③13.6gH2S的物质的量为![]() =0.4mol,④0.2molNH3;
=0.4mol,④0.2molNH3;
a.相同条件下,气体的体积之比等于物质的量之比,所以体积体积②>③>①>④,故a错误;
b.各物质的摩尔质量分别为①CH4为16g/mol②HCl为36.5g/mol③H2S为34g/mol④NH3为17g/mol,相同条件下,密度之比等于摩尔质量之比,所以密度②>③>④>①,故b正确;
c.各物质的质量分别为①CH4为0.3mol×16g/mol=4.8g,②HCl为0.5mol×36.5g/mol=18.25g,③H2S为13.6g,④NH3为0.2mol×17g/mol=3.4g,所以质量②>③>①>④,故c错误;
d.各物质中H原子的物质的量分别为①CH4为0.3mol×4=1.2mol②HCl为0.5mol③H2S0.4mol×2=0.8mol④NH3为0.2mol×3=0.6mol,所以氢原子个数①>③>④>②,故d正确;
故答案为bd;
(2)混合气体物质的量总和为:39.2L÷22.4L/mol=1.75mol,设CO和CO2的物质的量分别为x mol、y mol,则:x+y=1.75、28x+44y=61,解得x=1,y=0.75;CO的体积分数=![]() ×100%=57.1%,混合气体的摩尔质量为:61g÷1.75mol=34.9g/mol;
×100%=57.1%,混合气体的摩尔质量为:61g÷1.75mol=34.9g/mol;
(3)设气体总质量为100g,则m(O2 )=32g,m(N2)=28g,m(CO2)=22g,m(CH4)=16g,m(H2)=2g,故n(O2)=![]() =1mol,n(N2)=
=1mol,n(N2)=![]() =1mol,n(CO2)=
=1mol,n(CO2)=![]() =0.5mol,n(CH4)=
=0.5mol,n(CH4)=![]() =1mol,n(H2)=
=1mol,n(H2)=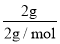 =1mol,则平均摩尔质量=
=1mol,则平均摩尔质量=![]() =22.22g/mol。
=22.22g/mol。


科目:高中化学 来源: 题型:
【题目】某氯原子的质量是ag,12C原子的质量是bg,用NA表示阿伏加德罗常数,下列说法正确的是( )
①该氯原子的相对原子质量一定是![]() ②mg该氯原子的物质的量一定是
②mg该氯原子的物质的量一定是![]() mol
mol
③该氯原子的摩尔质量是aNAg/mol ④ag该氯原子所含质子数是17mol
A. ①③④B. ①②④C. ②③④D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】36.5g氯化氢溶解在1L水中(水的密度近似为1g·mL-1),所得溶液的密度为ρg·mL-1,质量分数为w,物质的量浓度为cmol·L-1,NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
A. 所得溶液的物质的量浓度为1mol·L-1B. 36.5g氯化氢含有NA个原子
C. 36.5gHCl气体占有的体积约为22.4LD. 所得溶液的质量分数w=36.5c/1000ρ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g) +![]() O2(g)H2O(l)ΔH = -285.8 kJ/mol。下列说法不正确的是
O2(g)H2O(l)ΔH = -285.8 kJ/mol。下列说法不正确的是
A. H2的燃烧热为285.8 kJ/mol
B. 2H2(g) + O2(g)2H2O(l) ΔH = -571.6 kJ/mol
C. 1 mol H2完全燃烧生成气态水放出的热量大于285.8 kJ
D. 形成1 mol H2O的化学键释放的总能量大于断裂1 mol H2和0.5 mol O2 的化学键所吸收的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g) △H=-92kJ/mol,下列说法一定正确的是
2Z(g) △H=-92kJ/mol,下列说法一定正确的是
A. 混合气体的密度不随时间发生变化说明反应达到平衡状态
B. 充入氩气使压强增大,v正、v逆均増大
C. 反应达平衡时放出的热量小于92kJ
D. 反应达平衡状态时:2 v正(X)=v逆(Z)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是
A. 某溶液![]() 有白色沉淀,说明原溶液中有Cl-
有白色沉淀,说明原溶液中有Cl-
B. 某溶液![]() 有白色沉淀,说明原溶液中有SO42-
有白色沉淀,说明原溶液中有SO42-
C. 某溶液![]() 有蓝色沉淀,说明原溶液中有Cu2+
有蓝色沉淀,说明原溶液中有Cu2+
D. 某溶液![]() 生成无色气体,说明原溶液中有CO32-
生成无色气体,说明原溶液中有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以二氧化钛表面覆盖Cu2A12O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示,下列说法不正确的是

A. 由图可知:乙酸的生成速率随温度升高而升高
B. 250~300℃时,温度升高而乙酸的生成速率降低的主要原因是催化剂的催化效率降低
C. 由300~400℃可知,其他条件相同时,催化剂的催化效率越低,乙酸的生成速率越大
D. 根据图象推测,工业上制备乙酸最适宜的温度应为250℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中,两种气体的分子数一定相等的是 ( )
A. 温度相同、体积相同的O2和N2 B. 体积相等、密度不等的CO和C2H4
C. 质量相等、密度不等的CO和C2H4 D. 压强相同、体积相同的O2和N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为研究氯气的性质并模拟工业制备漂白粉,设计了下列装置进行实验。已知:①A中反应为 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;
②石灰乳的主要成分为Ca(OH)2,其他杂质不参与反应。

(1)B装置作用____。实验结束后,立即将 B 中溶液滴几滴在紫色石蕊试纸上,可观察到的现象是_____。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III处依次放入的物质正确的是___(填编号)。
编号 | I | II | III |
A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
B | 干燥的有色布条 | 浓硫酸 | 湿润的有色布条 |
C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
D | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
(3)待E中物质完全反应后,经过一系列加工处理,得到漂白粉样品,其主要成份为___(填化学式)
(4)F装置的作用是(用化学方程式表示)____。
(5)为测定(3)中所得漂白粉的有效成份含量。称取ag漂白粉样品溶解,往所得溶液中通入 CO2至产生沉淀最大值时,该过程的化学方程式为_____,若反应生成沉淀的物质的量为bmol,则该漂白粉中有效成份的质量分数为_____(用含a、b的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com