
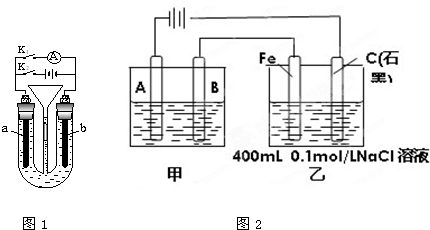
| 4.32g |
| 108g/mol |
| ||
| 0.04mol |
| 0.4L |


科目:高中化学 来源: 题型:
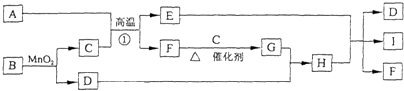
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+ Al3+ AlO2- Cl- |
| B、Mg2+ Al3+ SO42- NO3- |
| C、Ba2+ K+ SO42- NO3- |
| D、Na+ K+ ClO- S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
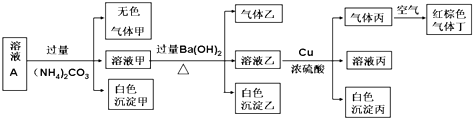
| A、沉淀乙一定有BaCO3,可能有BaSO4 |
| B、实验消耗Cu 14.4g,则生成气体丁的体积为3.36L |
| C、该溶液中一定有NO3-、Al3+、SO42-、Cl-四种离子 |
| D、生成的甲、乙、丙气体均为无色的易溶于水气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO32-、HCO3- |
| B、HSO3-、CO32- |
| C、SO32-、CO32- |
| D、HSO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴水中有下列平衡:Br2+H2O?HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 |
| B、反应 CO+NO2?CO2+NO (△H<0),达平衡后,提高温度体系颜色变深 |
| C、对于 2 HI?H2+I2 达平衡后,缩小体积可使体系颜色变深 |
| D、合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一个反应能否自发进行取决于该反应放热还是吸热 |
| B、同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大 |
| C、焓变是一个与反应能否自发进行有关的因素,多数能自发进行的反应都是放热反应 |
| D、一个反应能否自发进行,与焓变和熵变的共同影响有关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com