
| A、SO32-、HCO3- |
| B、HSO3-、CO32- |
| C、SO32-、CO32- |
| D、HSO3-、HCO3- |


科目:高中化学 来源: 题型:
| A、为了使食品较长时间保持色香味和口感,可加放适量的苯甲酸钠 |
| B、为了增加婴幼儿奶粉中的含氮量,可在奶粉中适当添加尿素或三聚氰胺 |
| C、在肉制品加工中加大量的亚硝酸钠以保持肉类新鲜 |
| D、在缺碘地区,人们需要用添加碘单质的食盐来补充碘元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化氢与氨气相遇,有大量的白雾生成 |
| B、SO2通入品红溶液,红色褪去,再加热,红色不再出现 |
| C、SO2具有氧化性,可用于漂白纸浆 |
| D、用铂丝蘸取硫酸钠溶液灼烧,火焰呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
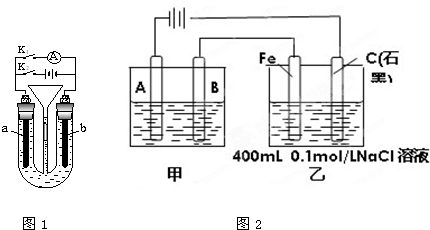
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH<7的溶液一定呈酸性 |
| B、0.1mol/LKOH溶液和0.1mol/L氨水中,其c(OH-)相等 |
| C、pH为1的盐酸的c(H+)是pH为3的盐酸的100倍 |
| D、Na2 CO3溶液中,c(Na+)是c(CO32-)的两倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该物质一定为电解质 |
| B、该物质可能为非电解质 |
| C、该物质一定是氯化钠 |
| D、该物质一定是氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol?L-1 | 0.08 | 0.20 | 0.44 |
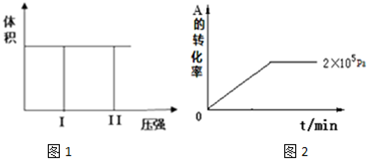
查看答案和解析>>
科目:高中化学 来源: 题型:
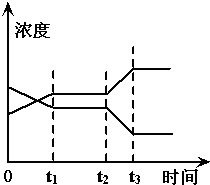 现有反应X(g)+Y(g)?2Z(g),△H>0.右图表示从反应开始到t1s时达到平衡,在t2s时由于条件变化使平衡破坏,到t3 s时又达平衡.则在图中t2 s时改变的条件可能是( )
现有反应X(g)+Y(g)?2Z(g),△H>0.右图表示从反应开始到t1s时达到平衡,在t2s时由于条件变化使平衡破坏,到t3 s时又达平衡.则在图中t2 s时改变的条件可能是( )| A、增大压强 |
| B、使用了催化剂 |
| C、升高温度 |
| D、减小了X或Y的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、1:2 |
| C、1:3 | D、2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com