
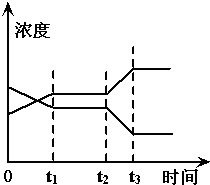
 现有反应X(g)+Y(g)?2Z(g),△H>0.右图表示从反应开始到t1s时达到平衡,在t2s时由于条件变化使平衡破坏,到t3 s时又达平衡.则在图中t2 s时改变的条件可能是( )
现有反应X(g)+Y(g)?2Z(g),△H>0.右图表示从反应开始到t1s时达到平衡,在t2s时由于条件变化使平衡破坏,到t3 s时又达平衡.则在图中t2 s时改变的条件可能是( )| A、增大压强 |
| B、使用了催化剂 |
| C、升高温度 |
| D、减小了X或Y的浓度 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO32-、HCO3- |
| B、HSO3-、CO32- |
| C、SO32-、CO32- |
| D、HSO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴水中有下列平衡:Br2+H2O?HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 |
| B、反应 CO+NO2?CO2+NO (△H<0),达平衡后,提高温度体系颜色变深 |
| C、对于 2 HI?H2+I2 达平衡后,缩小体积可使体系颜色变深 |
| D、合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸钠(固体) |
| B、水 |
| C、硫酸钾溶液 |
| D、硫酸铵(固体) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Z=0.75mol/L |
| B、Z=1mol/L |
| C、W=1mol/L |
| D、Z=0.8mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯碱工业电解饱和食盐水时,阳极电极反应式为 2Cl--2e-=Cl2↑ |
| B、精炼铜时,与电源正极相连的是纯铜,电极反应式为 Cu-2e-=Cu2+ |
| C、氢氧燃料电池的负极反应式 O2+2H2O+4e-=4OH- |
| D、钢铁发生电化腐蚀的正极反应式 Fe-2e-=Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一个反应能否自发进行取决于该反应放热还是吸热 |
| B、同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大 |
| C、焓变是一个与反应能否自发进行有关的因素,多数能自发进行的反应都是放热反应 |
| D、一个反应能否自发进行,与焓变和熵变的共同影响有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com