
【题目】回答下列填空:
(1)有下列分子或离子:①CS2,②PCl3,③H2S,④CH2O,⑤H3O+,⑥NH4+,⑦BF3,⑧SO2。粒子的立体构型为直线形的有________(填序号,下同);粒子的立体构型为V形的有________;粒子的立体构型为平面三角形的有________;粒子的立体构型为三角锥形的有____;粒子的立体构型为正四面体形的有____。
(2)俗称光气的氯代甲酰氯分子(COCl2)为平面三角形,但C—Cl键与C=O键之间的夹角为124.3°;C—Cl键与C—Cl键之间的夹角为111.4°,解释其原因:____。
【答案】① ③⑧ ④⑦ ②⑤ ⑥ C==O键与C-Cl键之间电子对的排斥作用强于C-Cl键与C-Cl键之间电子对的排斥作用
【解析】
(1)根据价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=![]() (a-xb),结合杂化轨道理论分析解答;
(a-xb),结合杂化轨道理论分析解答;
(2)从C=O键与C-Cl键排斥作用与C-Cl键与C-Cl键的排斥作用的大小分析解答。
①CS2中C的价层电子对个数=2+![]() =2,且不含孤电子对,为直线形分子;
=2,且不含孤电子对,为直线形分子;
②PCl3中P的价层电子对个数=3+![]() =4,且含有1个孤电子对,为三角锥形分子;
=4,且含有1个孤电子对,为三角锥形分子;
③H2S中S的价层电子对个数=2+![]() =4,且含有2个孤电子对,为V形分子;
=4,且含有2个孤电子对,为V形分子;
④CH2O中C的价层电子对个数=3+![]() =3,且不含孤电子对,为平面三角形分子;
=3,且不含孤电子对,为平面三角形分子;
⑤H3O+中O的价层电子对个数=3+![]() =4,且含有1个孤电子对,为三角锥形离子;
=4,且含有1个孤电子对,为三角锥形离子;
⑥NH4+中N的价层电子对个数=4+![]() =4,且不含孤电子对,为正四面体形;
=4,且不含孤电子对,为正四面体形;
⑦BF3中B的价层电子对个数=3+![]() =3,且不含孤电子对,为平面三角形;
=3,且不含孤电子对,为平面三角形;
⑧SO2中S的价层电子对个数=2+![]() =3,且含有1个孤电子对,为V形;
=3,且含有1个孤电子对,为V形;
立体构型为直线形的有①;粒子的立体构型为V形的有③⑧;立体构型为平面三角形的有④⑦,粒子的立体构型为三角锥形的有②⑤,粒子的立体构型为正四面体形的有⑥,故答案为:①;③⑧;④⑦;②⑤;⑥;
(2)C=O键与C-Cl键之间电子对的排斥作用强于C-Cl键与C-Cl键之间电子对的排斥作用,使得COCl2中C—Cl键与C=O键之间的夹角大于C—Cl键与C—Cl键之间的夹角,故答案为:C=O键与C-Cl键之间电子对的排斥作用强于C-Cl键与C-Cl键之间电子对的排斥作用。


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】某元素的一个原子形成的离子可表示为![]() n-,下列说法正确的是( )
n-,下列说法正确的是( )
A.![]() n-中含有的中子数为a+b
n-中含有的中子数为a+b
B.![]() n-中含有的电子数为a-n
n-中含有的电子数为a-n
C.X原子的质量数为a+b+n
D.一个X原子的质量约为![]() g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于丙烯(CH3—CH=CH2)的说法正确的是( )
A.丙烯分子中3个碳原子都是sp3杂化
B.丙烯分子有7个σ键,1个π键
C.丙烯分子存在非极性键
D.丙烯分子中3个碳原子在同一直线上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2+3H2![]() 2NH3,开始时N2的浓度为3 mol·L-1,H2的浓度为5 mol·L-1,3 min后测得NH3浓度为0.6 mol·L-1,则此时间内,下列反应速率表示正确的是( )
2NH3,开始时N2的浓度为3 mol·L-1,H2的浓度为5 mol·L-1,3 min后测得NH3浓度为0.6 mol·L-1,则此时间内,下列反应速率表示正确的是( )
A.v(H2)=0.3 mol·L-1·min-1B.v(N2)=1.0 mol·L-1·min-1
C.v(NH3)=0.2 mol·L-1·s-1D.v(H2)=1.67 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各选项有机物数目,与分子式为ClC4H7O2且能与碳酸氢钠反应生成气体的有机物数目相同的是(不含立体异构)( )
A. 分子式为C5H10的烯烃
B. 分子式为C4H8O2的酯
C. 甲苯( )的一氯代物
)的一氯代物
D. 立体烷( )的二氯代物
)的二氯代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M具有广谱抗菌活性,合成M的反应可表示如下:

下列说法正确的是
A. X分子中有2个手性碳原子
B. Y分子中所有原子一定不可能在同一平面内
C. 可用FeCl3溶液或NaHCO3溶液鉴别X和Y
D. 在NaOH溶液中,1 mol M最多可与5 mol NaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下![]() 与
与![]() 发生反应:
发生反应:![]() ,则下列关于元素M的叙述正确的是
,则下列关于元素M的叙述正确的是
A.M位于元素周期表中第VA族
B.M的氢化物的水溶液显酸性
C.![]() 中M元素只能被还原
中M元素只能被还原
D.![]() 在常温常压下一定是气体
在常温常压下一定是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
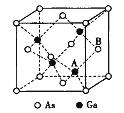
【题目】砷化稼(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)基态Ga原子的核外电子排布式为[Ar]_______________。
(2)根据元素周期律,元素的电负性Ga______(填“大于”或“小于”, 下同)As,第一电离能B ____ Ga;BF3和NH3的分子能够通过配位键相结合的原因是_______。
(3)杀虫剂Na3AsO4中阴离子的空问构型为______,As原子采取________杂化。
(4)组成相似的GaF3和GaCl3晶体,前者属于离子晶体,后者属于分子晶体。从F-和Cl-结构的不同分析其原因是____________。
(5)原子晶体GaAs的晶胞参数a=xpm,它的晶胞结构如下图所示。该晶胞内部存在的共价健数为______;A原子距离B原子所在六面体的侧面的最短距离为______ (用x表示)pm ;该晶胞的密度为_____g·cm-3。(阿伏伽德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含0.2molNaOH和0.1molBa(OH)2的溶液中持续稳定地通入6.72L(已换算成标准状况)CO2气体。下列表示溶液中离子的物质的量与通入CO2的体积关系的图象中,符合题意的是(气体的溶解和离子的水解都忽略不计)( )
A.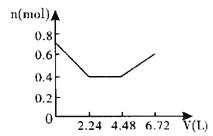
B.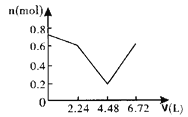
C.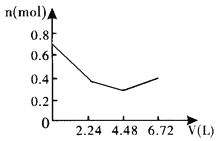
D.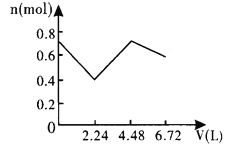
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com