
����Ŀ���о�CO2��CH4�ķ�Ӧʹ֮ת��ΪCO��H2���Լ���ȼ��Σ������������ЧӦ������Ҫ�����塣
��1����֪CH4(g)��CO2(g)![]() 2CO(g)��2H2(g) ��H����248kJ��mol��1����S��310J mol��1��K��1���÷�Ӧ���Է����е��¶ȷ�ΧΪ____________________��
2CO(g)��2H2(g) ��H����248kJ��mol��1����S��310J mol��1��K��1���÷�Ӧ���Է����е��¶ȷ�ΧΪ____________________��
��2�����ܱպ���������ͨ�����ʵ���Ũ�Ⱦ�Ϊ0.1 mol��L��1��CH4��CO2����һ�������·�����ӦCH4(g)��CO2(g)![]() 2CO(g)��2H2(g)�����CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
2CO(g)��2H2(g)�����CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��

�ٹ�ҵ����ʱһ���ѡ��P4��1250����кϳɣ��������ԭ��_________________________��
����ѹǿΪP4��1100��������£��÷�Ӧ5minʱ�ﵽƽ���X������CO��ʾ�÷�Ӧ������Ϊ_____�����¶��£���Ӧ��ƽ�ⳣ��Ϊ_____________________������3λ��Ч���֣���
��3��CO��H2�ڹ�ҵ�ϻ�����ͨ����ӦC(s)��H2O(g) ![]() CO(g)��H2 (g)����ȡ
CO(g)��H2 (g)����ȡ
���ں��º����£�����ӷ�Ӧ���������ƽ�⣬���϶��Ѵ�ƽ��״̬����____________________��
A����ϵѹǿ���ٱ仯 B��H2��CO��H2O�����ʵ���֮��Ϊ1:1:1
C�����������ܶȱ��ֲ��� D������ƽ����Է����������ֲ���
����ij����ɱ���ܱ�������ͬʱͶ���������ʣ�2minʱ�ﵽƽ�⣬�����������1mol H2O(g)��1mol CO(g)��2.2molH2(g)��������C(s)�������ʱ����ϵ��ѹ��ƽ����___________(��������桱)��Ӧ�����ƶ����ﵽ�µ�ƽ��������ƽ��Ħ������Ϊ_____________________��
���𰸡� ����800K �ϴ��ѹǿ���¶��ܼӿ�ϳ����ʣ��������Ч�� 0.032mol��L��1��min��1 1.64 ACD �� 12 g/mol
��������(1)CH4(g)��CO2(g)![]() 2CO(g)��2H2(g) ��H����248kJ��mol��1����S��310J mol��1��K��1����G=��H-T��S��0����Ӧ���Է����У�����G=��H-T��S=(��248kJ��mol��1)-T��(310J mol��1��K��1)��0�����T��800K���ʴ�Ϊ������800K��
2CO(g)��2H2(g) ��H����248kJ��mol��1����S��310J mol��1��K��1����G=��H-T��S��0����Ӧ���Է����У�����G=��H-T��S=(��248kJ��mol��1)-T��(310J mol��1��K��1)��0�����T��800K���ʴ�Ϊ������800K��
(2)����ͼ��֪�������¶ȣ������ת�������÷�Ӧ����Ӧ�������������ķ�Ӧ������ѹǿƽ�����淴Ӧ���У������ת���ʽ��ͣ����ϴ��ѹǿ�ܼӿ�ϳ����ʣ��������Ч�ʣ��ʴ�Ϊ���ϴ��ѹǿ���¶��ܼӿ�ϳ����ʣ��������Ч�ʣ�
����ͼ1��֪��ѹǿΪP4��1100��������£��÷�Ӧ5minʱ�ﵽƽ��X�㣬�Ǽ����ת����Ϊ80%�������Ũ�ȱ仯��Ϊ0.1mol/L��80%=0.08mol/L����v(CH4)=![]() =0.016mol/(Lmin)����������֮�ȵ��ڻ�ѧ������֮�ȣ�����v(CO)=2v(CH4)=2��0.16mol/(Lmin)=0.032mol/(Lmin)��
=0.016mol/(Lmin)����������֮�ȵ��ڻ�ѧ������֮�ȣ�����v(CO)=2v(CH4)=2��0.16mol/(Lmin)=0.032mol/(Lmin)��
CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g)��
2CO(g)+2H2(g)��
��ʼ(mol/L)��0.1 0.1 0 0
�仯(mol/L)��0.08 0.08 0.16 0.16
ƽ��(mol/L)��0.02 0.02 0.16 0.16
�ʸ��¶���ƽ�ⳣ��K=![]() =1.64���ʴ�Ϊ��0.032mol/(Lmin)��1.64��
=1.64���ʴ�Ϊ��0.032mol/(Lmin)��1.64��
(3)��A������Ӧ�����Ǹ������������ķ������ŷ�Ӧ�Ľ��У�ƽ��֮ǰ����ϵѹǿ������һ������ϵѹǿ���䣬˵����Ӧ��ƽ�⣬��A��ȷ��B��H2��CO��H2O�Ļ�ѧ������Ϊ1��1��1�����ʵ���֮��Ϊ1:1:1������ʼʱ��ˮ���������ʵ����йأ���ƽ��״̬�أ�����˵������ƽ�⣬��B����C�����������ܶ���=![]() ���������ݣ���V���䣬���ŷ�Ӧ�Ľ��У�������������m����������һ����������ʱ��˵����Ӧ��ƽ�⣬��C��ȷ��D����Ӧ���������������䣬�淴Ӧ���У���Ӧ�������ܵ����ʵ�������ƽ����Է���������С����������ƽ����Է��������������仯��˵������ƽ�⣬��D��ȷ����ѡACD��
���������ݣ���V���䣬���ŷ�Ӧ�Ľ��У�������������m����������һ����������ʱ��˵����Ӧ��ƽ�⣬��C��ȷ��D����Ӧ���������������䣬�淴Ӧ���У���Ӧ�������ܵ����ʵ�������ƽ����Է���������С����������ƽ����Է��������������仯��˵������ƽ�⣬��D��ȷ����ѡACD��
�ڸ�����ɳ����ԭ����֪������ѹǿ��ƽ���������������С�ķ����ƶ����˷�Ӧ���淴Ӧ�����Ǹ����������С�ķ�������ѹǿ�����淴Ӧ�����ƶ����ڵ�2minʱ����������ƽ����Է���������ƽ��Ħ������![]() =
=![]() =
=![]() =12g/mol���ʴ�Ϊ���棻12 g/mol��
=12g/mol���ʴ�Ϊ���棻12 g/mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������������л��������빦�ܹ�ϵͼ���й������������

A. С������ϸ���У�����A�������ǣ�����E�ǵ���
B. ��ͬ������E��F���������ֽ⣬�ͷ������϶����F
C. ����C������Լ��20�֣��������Ԫ����C��H��O��N
D. SARS����������H����ˮ�������CO2��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����G=��H��T��S������G��0����Ӧ���Է���������G��0��Ӧ�����Է�������ij��Ӧ2AB(g�� ![]() C(g����3D(g���ڸ���ʱ���Է����У��ڵ����²����Է����У���÷�Ӧ������Ӧ����H����SӦΪ
C(g����3D(g���ڸ���ʱ���Է����У��ڵ����²����Է����У���÷�Ӧ������Ӧ����H����SӦΪ
A. ��H��0����S��0 B. ��H��0����S��0
C. ��H��0����S��0 D. ��H��0�� ��S��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з���������ԭ�Ӷ����������Ϊ8���ӽṹ���ǣ� ��
A.BF3B.H2OC.CCl4D.PCl5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�� 25��ʱ�����ʵ���Ũ�Ⱦ�Ϊ0.1mol/L������������Һ��
�� Na2CO3��Һ �� NaHCO3��Һ �� NaF��Һ ��NaClO��Һ�����������ж�pH�ɴ�С��˳����_________________________��
��2�����ˮƿˮ���к��е�CaSO4�ķ���������ˮƿ�е�ˮ����̼���Ʊ�����Һ���ݺ��ˮ��ϴ���ټ������ἴ�ɣ���д��������Ӧ�Ļ�ѧ����ʽ��________________��_____________ ��
��3��Na2CO3��Һ�Լ�������ΪCO32-ˮ���Ե�ʣ�����Ƽ�ʵ����ʵ֤��֮____________________��
��4������ƽ�ⳣ������K��ʾ)��һ��ƽ�ⳣ��������ƽ�ⳣ���Ĵ�С�����жϵ���ʵ����ǿ����25��ʱ���й����ʵĵ���ƽ�ⳣ�����±���ʾ��
��ѧʽ | HF | H2CO3 | HClO |
����ƽ�ⳣ����K�� | 7.2��10-4 | K1=4.4��10-7 K2=4.7��10-11 | 3.0��10-8 |
�����ĵ��뷽��ʽΪ____________________�����������ƽ�ⳣ���ı���ʽΪ_______________��
��5��25��ʱ��pH=3��HF��Һ�У�δ����ķ��������ʵ���Ũ��Ϊ_______________________mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ӣ������˹�ش�ѧ��ѧ�Ұ����ҡ���ķ�Ϳ�˹̹����ŵ��Ф���ͬ��������Ķ�����ͻ���Եء���˺�ѵķ����ɹ���ó�������ʯīϩ�����Ʊ�ʯīϩ������ʯī���뷨����ѧ����������ȡ�ʯīϩ�����ģ��ʾ��ͼ���£�

��1�������й�ʯīϩ˵����ȷ����________________��
A��������ʯīϩ>���ʯ
B��ʯīϩ����������ԭ�ӿ��Դ���ͬһƽ��
C��12gʯīϩ��![]() ����ΪNA
����ΪNA
D����ʯī�����ʯīϩ��˷�ʯī�����֮��ķ��Ӽ�������
��2����ѧ����������ǻ�ô���ʯīϩ����Ч����֮һ������Ϊ��ͭ���ܵȽ�����Ͻ𣬺�̼Դ�����Ǽ��顢��Ȳ�������Ҵ���̪ݼ���е�һ�ֻ�������ϡ�
��ͭԭ���ڻ�̬ʱ�����е��������ܼ��У�������ߵ��ܼ�����Ϊ_____________����������Ԫ���У�������������ͭ��ͬ��Ԫ�ػ���________________________��
���Ҵ��ķе�Ҫ������Է��������������ߵĶ��飬�����ԭ��______________________________��
�����з������ڷǼ��Է��ӵ���__________________��
a������ b�����ȼ��� c���� d���Ҵ�
��̪ݼ��̪ݼͭȾ�Ϸ��ӽṹ��ͼ��̪ݼ������̼ԭ�Ӳ��õ��ӻ���ʽ��__________��̪ݼͭ��������ԭ�ӵ���λ��Ϊ________________��
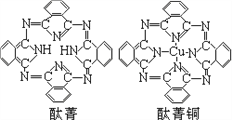
�ݽ���ͭ���γɵĽ���������Ͻ���ͼ���þ����У�Auռ���������8�����㣩��

���Ļ�ѧʽ�ɱ�ʾΪ_____����Au��Χ�����������ȵ�Cu��_____������2��Cuԭ�Ӻ˵���С����Ϊd pm���þ�����ܶȿ��Ա�ʾΪ___________________g/cm3��������٤��������NA��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����豶���������к��в��ӣ���������Ŀǰ�в����˹��ϳɵĴ���Ȼ����ܡ���Ч�ܵĿ������������ɻ�������������ûʳ�Ӷ�����(EGC)�Ľṹ��ͼ��ʾ������EGC������˵������ȷ����
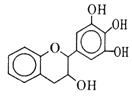
A. ��FeCl3��Һ��������ɫ��Ӧ
B. 1 mol EGC��4 mol NaOHǡ����ȫ��Ӧ
C. ����������Ӧ��ȡ����Ӧ���ѷ����ӳɷ�Ӧ
D. ���������е�ԭ�ӹ�ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ԫ�����ڱ����ش��������⣺
��1�����е�ʵ����Ԫ�����ڱ��IJ��ֱ߽磬����ͼ 1 ����ʵ�߲�ȫԪ�����ڱ� �ı߽�____________

��2����������Ԫ�أ����ڶ�����Ԫ�ص���____________����������Ԫ�ص���____________��g Ԫ��λ�ڵ�____________ ����____________ �壻i Ԫ��λ�ڵ�____________ ����____________�壮
��3��Ԫ�� f �ǵ�_______���ڡ���_______ ��Ԫ�أ�������ͼ 3 ��ʾ�ķ����а� ��Ԫ�أ�ͼ 2����ʽ��д����Ԫ�ص�ԭ��������Ԫ�ط��š�Ԫ�����ơ����ԭ�� ����_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������2molL��1��Na2CO3��Һ950mL������ʱӦѡ�õ�����ƿ�Ĺ��ͳ�ȡNa2CO3�������ֱ��ǣ� ��
A.1000mL��212g
B.950mL��543.4g
C.1000mL��201.4g
D.500mL��286g
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com