
【题目】钙能调节人体各系统生理功能,利用如图装置测定碳酸钙型补钙剂中钙的含量。已知氨基磺酸(H2NSO3H)俗称固体硫酸,在水溶液中为一元酸,广泛应用于锅炉水垢的清洗。
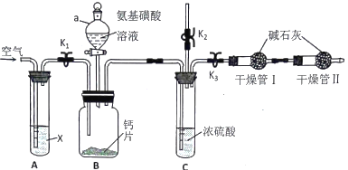
(1)仪器a的名称为____________________。
(2)A装置内X是___________________溶液(填化学式),B 装置内发生反应的化学方程式为____________________________。
(3)组装好仪器后,检查装置的气密性,接下来进行的操作是:打开K1、K2,关闭K3,通空气一段时间,关闭K1、K2,打开K3,打开仪器a活塞,滴入氨基磺酸溶液,待B装置中无气泡产生,关闭仪器a活塞。再次打开K1通空气一段时间,第二次通入空气目的是___________________________。干燥管Ⅱ的作用_________________________。
(4)取某补钙剂样品m克进行测定,测得干燥管Ⅰ在实验前后重量分别为m1克和m2克,则样品中钙的质量分数为____________________________。
【答案】分液漏斗 NaOH CaCO3+2H2NSO3H=Ca( H2NSO3)2+H2O+CO2 ↑ 将装置内CO2排至干燥管Ⅰ中,提高CO2吸收率 吸收空气中的CO2和H2O ![]() ×100%
×100%
【解析】
根据实验目的要测样品中钙的质量分数,找到![]() CaCO3
CaCO3![]() CO2 关系,围绕碱石灰增重的量进行求解。因为空气中含有CO2,所以要排净空气的CO2干扰。
CO2 关系,围绕碱石灰增重的量进行求解。因为空气中含有CO2,所以要排净空气的CO2干扰。
(1)根据装置图可知仪器a的名称为分液漏斗;答案:分液漏斗。
(2)本实验目的是测定碳酸钙型补钙剂中钙的含量,是通过测定磺酸(H2NSO3H)与碳酸钙反应生成CO2的量来完成,所以要先排净装置中的空气,防止空气中的CO2气体造成误差,所以A装置内X应为NaOH 溶液,除去空气中的CO2,B装置内是磺酸(H2NSO3H)与碳酸钙反应生成CO2和磺酸钙,发生反应的化学方程式为CaCO3+2H2NSO3H=Ca( H2NSO3)2+H2O+CO2 ↑;答案:NaOH;CaCO3+2H2NSO3H=Ca( H2NSO3)2+H2O+CO2 ↑。
(3)第二次通入空气目的是将装置内CO2排至干燥管Ⅰ中,提高CO2吸收率;答案:将装置内CO2排至干燥管Ⅰ中,提高CO2吸收率;
(4)测得干燥管在实验前后重量分别为m1g和m2g,即二氧化碳的质量分数为(m2-m1)g,二氧化碳的物质的量为![]() mol,根据方程式CaCO3+2H2NSO3H=Ca( H2NSO3)2+H2O+CO2 ↑,计算出碳酸钙的物质的量为
mol,根据方程式CaCO3+2H2NSO3H=Ca( H2NSO3)2+H2O+CO2 ↑,计算出碳酸钙的物质的量为![]() mol,根据CaCO3
mol,根据CaCO3![]() ,所以钙的质量为:
,所以钙的质量为:![]() mol
mol ![]() g/mol=
g/mol= ![]() g;所以钙的质量分数为=
g;所以钙的质量分数为=![]() ×100%;答案:
×100%;答案:![]() ×100%。
×100%。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】如图所示,在U形管中装入滴有紫色石蕊试液且混合均匀的某溶液,通直流电一段时间后,U形管内会形成一个倒立的“彩虹”,则U形管内的溶液可能为( )

A.NaC1溶液B.NaOH溶液C.CuSO4溶液D.Na2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、HCO3-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图像如图所示,下列说法正确的是
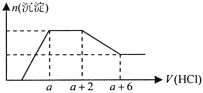
A.原溶液中一定含有的阴离子是OH-、SiO32-、AlO2-、CO32-
B.反应最后形成的溶液中的溶质为NaCl
C.原溶液中一定含有Na2SO4
D.原溶液中含有CO32-与AlO2-的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y都是芳香族化合物,均为常见食用香精,广泛用于化妆品、糖果及调味品中。1 molX水解得到1 mol Y和1 mol CH3CH2OH,X、Y的分子量都不超过200,完全燃烧都只生成CO2和H2O。且X分子中碳和氢元素总的质量百分含量约为81.8%。
(1) X、Y分子量之差为___________________。
(2)1个Y分子中应该有____________个氧原子。
(3) X的分子式是_____________________________________。
(4) G和X互为同分异构体,且具有相同的官能团,用芳香烃A合成G路线如下:
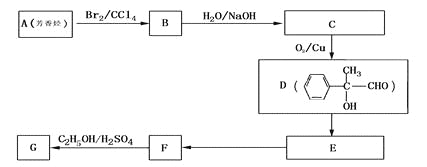
①写出A的结构简式____________________
② E→F的反应类型是_________反应,该反应的化学方程式为:____________________。
③写出所有符合下列条件的F的同分异构体的结构简式:
ⅰ.分子内除了苯环无其他环状结构,且苯环上有2个对位取代基。
ⅱ.一定条件下,该物质既能与银氨溶液发生银镜反应又能和FeCl3溶液发生显色反应。
______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 红棕色的NO2加压后颜色先变深后变浅 B. 温度过高对合成氨不利
C. 钢铁在潮湿的空气中容易生锈 D. 常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124 g P4中所含P-P键数目为4NA
B. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
C. 1mol FeI2与足量氯气反应时转移的电子数为2NA
D. 13g由![]() C和
C和![]() 组成的碳单质中所含质子数一定为6NA
组成的碳单质中所含质子数一定为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是实验室制取Cl2并以Cl2为原料进行特定反应的实验:

(1)A为氯气发生装置,写出反应的化学方程式_____________________.
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯.Cl2通入C瓶后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl(气),试写出D装置中反应的化学方程式_______________.装置C的作用是________________.
(3)E处石蕊试液的现象是_____________,其原因是________________.
(4)若将E处溶液改为澄清石灰水,反应过程的现象是___________.
A.有白色沉淀生成 B.无白色沉淀生成
C.先生成白色沉淀,然后沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是________________________________________.B的作用是___________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A. 1 mol SiO2晶体中,含有 SiO键的数目为2 NA
B. 16.8 g铁粉与足量高温水蒸气反应,转移电子数为0.8 NA
C. 1 mol·L1AlCl3溶液中,含有Cl的数目为3 NA
D. 18 g D2O和H2O的混合物中,含有的中子数为9 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
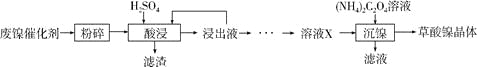
【题目】草酸镍晶体(NiC2O4·2H2O)可用于制镍催化剂,硫酸镍晶体(NiSO4·7H2O)主要用于电镀工业。某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如下:
已知:①相关金属离子生成氢氧化物沉淀的pH如下表(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Al3+ | 3.0 | 5.0 |
Ni2+ | 6.7 | 9.5 |
②Ksp(CaF2)=1.46×10-10,Ksp(CaC2O4)=2.34×10-9。
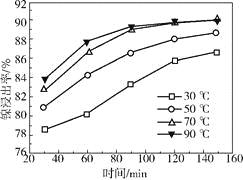
(1)“粉碎”的目的是____________。
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如右图。“酸浸”的适宜温度与时间分别为_________(填字母)。
a.30℃、30min
b.90℃、150min
c.70℃、120min
d.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是___________。
(4)将“沉镍”工序得到的混合物过滤,所得固体用乙醇洗涤、110 ℃下烘干,得草酸镍晶体。
①用乙醇洗涤的目的是_________________。
②烘干温度不超过110℃的原因是_________________。
(5)由流程中的“浸出液”制备硫酸镍晶体的相关实验步骤如下:
第1步:取“浸出液”,___,充分反应后过滤,以除去铁、铝元素;
第2步:向所得滤液中加入适量NH4F溶液,充分反应后过滤,得“溶液X”;
第3步:___,充分反应后过滤;
第4步:滤渣用稍过量硫酸充分溶解后,蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得硫酸镍晶体。
①请补充完整相关实验步骤(可选试剂:H2SO4溶液、NaOH溶液、HNO3溶液、H2O2溶液)。
②第2步中加入适量NH4F溶液的作用是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com