
����Ŀ��Cl2O����ˮ��Ӧ���ɴ����ᣬ��ɱ������״�����ȶ��ֲ�����һ���Ʊ�Cl2Oԭ��ΪHgO(��ɫ��ĩ��+2Cl2=HgCl2(��ɫ��ĩ��+Cl2O��ij��ѧС������ͼװ���Ʊ�Cl2O(�г�װ����ȥ��
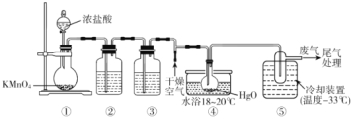
��֪����Cl2O���۵�Ϊ-116��C���е�Ϊ3.8��C��������ˮ���ڸ�Ũ�ȵ�Cl2O�ױ�ը��Cl2O���л���Ӵ������ʱ�ᷢ�����ҷ�Ӧ��
����˵���������
A.װ�â���ʢװ���Լ��DZ���ʳ��ˮ�����������Ǻ�ɫ��ĩ��Ϊ��ɫ
B.װ�â���������������������ֹCl2O��������Ӧ
C.��װ�â����ݳ��������Ҫ�ɷ���Cl2O
D.ͨ����������Ŀ���ǽ����ɵ�Cl2Oϡ�ͣ���ֹ������ը
���𰸡�AC
��������
����Ũ�����������ط���������ԭ��Ӧ������������Ϊ����ʳ��ˮ�ɳ�ȥ�����е�HCl������Ũ���������������������װ�â�����HgO��Ӧ����Cl2O���壬�ɷе��֪���������õ�Cl2OҺ�壬������������Ϊ������������Cl2����Ũ�ȵ�Cl2O�ױ�ը����������Ŀɽ����ɵ�Cl2Oϡ�ͣ���ֹ������ը��
A�����ݷ�����֪װ�â���Ϊ����ʳ��ˮ��װ�â���ΪŨ���������������A����
B���������л��Cl2O���л���Ӵ������ʱ�ᷢ�����ҷ�Ӧ������������������������B��ȷ��
C��Cl2O�ķе�Ϊ3.8��C����װ�â���������Һ�壬������������Ϊ������������Cl2����C����
D����Ũ�ȵ�Cl2O�ױ�ը����������Ŀɽ����ɵ�Cl2Oϡ�ͣ���ֹ������ը����D��ȷ��
�ʴ�ΪAC��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ��ҺX��ֻ��������Na����Mg2����Al3����![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() �е����������ӡ�ijͬѧ�Ը���Һ����������ʵ�飺
�е����������ӡ�ijͬѧ�Ը���Һ����������ʵ�飺
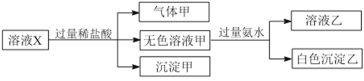
�����ж���ȷ����
A.�����һ���Ǵ�����B.�������ǹ������þ�Ļ����
C.Na����![]() ��
��![]() һ����������ҺX��D.
һ����������ҺX��D.![]() ��
��![]() һ������������ҺX��
һ������������ҺX��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ4NH3��������5O2������![]() 4NO��������6H2O��������10L�ܱ������н��У�����Ӻ�ˮ���������ʵ���������0.45mol����˷�Ӧ��ƽ�������� (X)(��Ӧ����������ʻ�������������)�ɱ�ʾΪ( )
4NO��������6H2O��������10L�ܱ������н��У�����Ӻ�ˮ���������ʵ���������0.45mol����˷�Ӧ��ƽ�������� (X)(��Ӧ����������ʻ�������������)�ɱ�ʾΪ( )
A. ��(NH3)=0.0100mol��L-1��s-1B. ��(O2)=0.0010 mol��L-1��s-1
C. ��(NO)=0.0010 mol��L-1��s-1D. ��(H2O)=0.045 mol��L-1��s-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǻ���������������ʳƷ����������ҵ�Ͽ������з����Ʊ�������˵���������
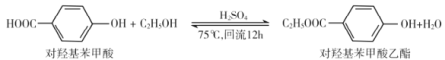
A.���ǻ��������ܷ������۷�Ӧ��ȡ����ӦB.����Ũ��ˮ����������Ƿ��ж��ǻ���������������
C.lmol���ǻ����������������2molNaOH��ӦD.�Ҵ���ˮ���ɵ���ϩ������˳���칹
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ӵ��������ᡱ����Ҫ��Ӧ��2SO2+O2![]() 2SO3�ڴ�������ķ�Ӧ�������£�
2SO3�ڴ�������ķ�Ӧ�������£�
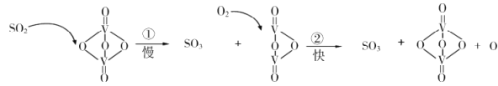
����˵����ȷ����
A.ʹ�ô���ֻ�ܼӿ�����Ӧ����B.��Ӧ�ڵĻ�ܱȷ�Ӧ�ٴ�
C.�÷�Ӧ�Ĵ�����V2O4D.�����м���V��O���Ķ��ѣ�����V��O�����γ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ڵ���������Ҫ��������ʣ�����ķ�����������(����)
A.H2��CO2(CO)![]()
![]()
B.H2(CO2��HCl) ![]()
![]()
C.O2(CO) ![]()
![]()
D.CO(H2O��CO2) ![]()
![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1200��ʱ����Ȼ���������лᷢ�����з�Ӧ
��H2S(g)+![]() O2(g)=SO2(g)+H2O(g) ��H1 ��2H2S(g)+SO2(g)=
O2(g)=SO2(g)+H2O(g) ��H1 ��2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) ��H2
S2(g)+2H2O(g) ��H2
��H2S(g)+![]() O2(g)=S(g)+H2O(g) ��H3 ��2S(g)=S2(g) ��H4
O2(g)=S(g)+H2O(g) ��H3 ��2S(g)=S2(g) ��H4
����H4����ȷ����ʽΪ
A.��H4=![]() (��H1+��H2-3��H3)B.��H4=
(��H1+��H2-3��H3)B.��H4=![]() (3��H3-��H1-��H2)
(3��H3-��H1-��H2)
C.��H4=![]() (��H1+��H2-3��H3)D.��H4=
(��H1+��H2-3��H3)D.��H4=![]() (��H1-��H2-3��H3)
(��H1-��H2-3��H3)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����200mlBaCl2��Һ�ȷ�Ϊ���ݣ�һ���м���100ml���ʵ���Ũ��Ϊ0.1mol/L��ϡ���ᣬǡ����ȫ��������һ���м�������AgNO3��Һ��ʹ���ֳ������Լ��㣺
(1)��BaCl2��Һ�����ʵ���Ũ����________
(2)������Ӧ�����ɵ�AgCl������������________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ⶨ�Ҵ��Ľṹʽ���������������ˮ�ƾ����Ʒ�Ӧ��ʵ��װ�úͲⶨ���������װ�ý���ʵ�顣�ɹ�ѡ�õ�ʵ��������ͼ��ʾ��
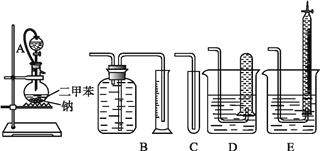
��ش��������⣺
��1������������������װ����_____(����)��
��2��װ����A���ֵķ�Һ©������ƿ֮�����ӵĵ��������������___(����)��
A����ֹ��ˮ�ƾ��ӷ�
B����֤ʵ��װ�ò�©��
C��ʹ��ˮ�ƾ�˳������
��3��ʵ��ǰԤ�Ƚ�С�����ڶ��ױ����ۻ������ɸ�С���飬��ȴ������ƿ�У���Ŀ����____��
��4����֪��ˮ�ƾ����ܶ�Ϊ0.789 g��cm3����ȡ2.0 mL�ƾ�����Ӧ��ȫ��(�ƹ���)���ռ���390 mL(������״��)���塣��һ���Ҵ��������ܱ���ȡ������ԭ����Ϊ___���ɴ˿�ȷ���Ҵ��ĽṹʽΪ_________��������_________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com