
【题目】水溶液X中只可能溶有Na+、Mg2+、Al3+、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种离子。某同学对该溶液进行了如下实验:
中的若干种离子。某同学对该溶液进行了如下实验:
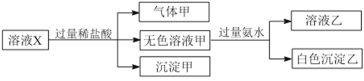
下列判断正确的是
A.气体甲一定是纯净物B.沉淀甲是硅酸和硅酸镁的混合物
C.Na+、![]() 和
和![]() 一定存在于溶液X中D.
一定存在于溶液X中D.![]() 和
和![]() 一定不存在于溶液X中
一定不存在于溶液X中
【答案】C
【解析】
溶液中加入过量盐酸后有气体生成,说明原溶液中至少含有![]() 、
、![]() 中的一种,有沉淀生成,说明原溶液中一定含有
中的一种,有沉淀生成,说明原溶液中一定含有![]() ,有
,有![]() 就一定不存在Al3+和Mg2+,阳离子只剩下Na+,则一定存在Na+;当所得溶液甲继续加氨水时产生沉淀,沉淀只能是氢氧化铝,说明有Al3+存在,而该Al3+是由
就一定不存在Al3+和Mg2+,阳离子只剩下Na+,则一定存在Na+;当所得溶液甲继续加氨水时产生沉淀,沉淀只能是氢氧化铝,说明有Al3+存在,而该Al3+是由![]() 与过量盐酸反应而转变所得,即一定存在
与过量盐酸反应而转变所得,即一定存在![]() ;而
;而![]() 没有检验,则可能存在。
没有检验,则可能存在。
A. 根据分析,原溶液中至少含有![]() 、
、![]() 中的一种,若
中的一种,若![]() 、
、![]() 同时存在,则气体甲是混合物(二氧化碳和二氧化硫混合气体),A错误;
同时存在,则气体甲是混合物(二氧化碳和二氧化硫混合气体),A错误;
B. 溶液中一定不含有Mg2+,沉淀甲是硅酸,B错误;
C. 溶液中一定存在Na+、![]() 和
和![]() ,C正确;
,C正确;
D. ![]() 和
和![]() 可能存在于溶液中,D错误。
可能存在于溶液中,D错误。
答案选C。


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可按下面框图进行反应。又知E溶液是无色的。

请回答:
(1)A是________,B是________,C是________(填化学式)。
(2)反应①的化学方程式为____________________________。
(3)反应③的化学方程式为____________________________。
(4)反应④的化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表表示合成氨反应(N2+3H2![]() 2NH3)在不同条件下达到平衡时混合物中氨的含量[起始时v(N2):v(H2)==1:3]。
2NH3)在不同条件下达到平衡时混合物中氨的含量[起始时v(N2):v(H2)==1:3]。
|
|
|
|
|
|
200 | 0.153 | 0.815 | 0.899 | 0.954 | 0.988 |
300 | 0.022 | 0.520 | 0.710 | 0.842 | 0.926 |
400 | 0.004 | 0.251 | 0.470 | 0.652 | 0.798 |
分析上表数据,回答下列问题:
(1)200℃、100MPa时,平衡混合物中氨的含量已达0.988,如果继续增大压强______
(填“能”或“不能”)使平衡混合物中氨的含量等于1,理由是:___________________________________________________________________________________________。
(2)欲使平衡混合物中氨的含量增大,则可采取的措施有:____________________。
(3)欲使平衡混合物中氨的含量为0.710,则选择的反应条件应为:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),反应进行到10 s末,达到平衡,测得A的物质的量为1.8 mol,B的物质的量为0.6 mol,C的物质的量为0.8 mol。
(1)用C表示10 s内反应的平均反应速率为________。
(2)反应前A的物质的量浓度是________。
(3)10 s末,生成物D的浓度为________。
(4)A与B的平衡转化率之比为________。
(5)反应过程中容器内气体的平均相对分子质量变化是________(填“增大”、“减小”或“不变”,下同),气体的密度变化是________。
(6)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):①降低温度______;②增大A的浓度________;③恒容下充入氖气_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将amol氮气与bmol氢气的混合气体通入一个固定容积的密闭容器中,发生反应N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol,则a值为________。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中氨气体积分数为25%,平衡时氨气的物质的量为________。
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同)n始∶n平=________。
(4)原气体中a∶b=________。
(5)达到平衡时,N2和H2的转化率之比α(N2)∶α(H2)=________。
(6)达到平衡时混合气体中,n(N2)∶n(H2)∶n(NH3)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氟化氮(NF3)是一种无色、无臭的气体。三氟化氮在一定条件下与水蒸气能发生氧化还原反应,反应产物中生成酸 X、酸 Y 和一种无色气体(遇空气变成红棕色),其中酸 X 是一种弱酸,酸Y 为常见的含氧强酸。
(1)NF3的空间构型为__________。
(2)酸X是弱酸(难电离)的可能原因是______。
(3)工业上通过 NH3 和氟气(F2)反应制备 NF3,请结合题给信息,判断NF3主要表现出来的化学性质是_______。
(4)NF3的一种下游产品三聚氟氰(分子式为:C3N3F3),分子结构中显示有环状结构,请从价键理论和物质的相对稳定性角度写出三聚氟氰的结构式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔盐[(NH4)2Fe(SO4)26H2O]是一种浅绿色晶体,广泛应用于电镀工业。为探 究其分解产物,某学习小组利用如图所示装置进行实验。
(查阅资料)隔绝空气加热至500°C时,摩尔盐能完全分解,分解产物中有铁氧化物, 硫氧化物,氨气和水蒸气等。

(1)对A装置加热前,先通一段时间N2的目的是_______。
(2)实验开始一段时间后,装置B中的现象为______。
(3)实验中观察到装置D始终无明显现象,装置C中和E中均产生白色沉淀。
①写出E中SO2与H2O2发生反应的化学方程式:_______。
②甲同学根据C中产生白色沉淀现象判断产物中一定含有SO3。请对甲同学的判断作出评价,并说明理由:_____。
(4)实验结束后,装置A中的固体变为红棕色,请补充完整检验该残留固体中是否含 FeO或Fe3O4的实验方案:取A中少量残留固体,加入稀硫酸使其完全溶解,向 溶液中滴加 ________,若观察到 ______,说明残留固体中不含FeO和Fe3O4。(提供的试剂有:NaOH溶液、氯水、硫氰化钾溶液、酸性高锰酸钾溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的甲烷在O2不足的情况下燃烧,得到CO、CO2和H2O的总质量为14.4 g,若其中水的质量为7.2 g,则CO的质量是 ( )。
A. 2.8 gB. 4.4 gC. 5.6 gD. 在2.8 g~5.6 g之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2O能与水反应生成次氯酸,可杀死新型冠状病毒等多种病毒。一种制备Cl2O原理为HgO(红色粉末)+2Cl2=HgCl2(白色粉末)+Cl2O,某化学小组用下图装置制备Cl2O(夹持装置略去)
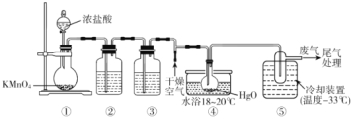
已知:①Cl2O的熔点为-116°C、沸点为3.8°C,易溶于水;②高浓度的Cl2O易爆炸,Cl2O与有机物接触或加热时会发生剧烈反应。
下列说法错误的是
A.装置③中盛装的试剂是饱和食盐水,④中现象是红色粉末逐渐变为白色
B.装置④中橡胶塞用锡箔包裹,防止Cl2O与橡胶塞反应
C.从装置⑤中逸出气体的主要成分是Cl2O
D.通入干燥空气的目的是将生成的Cl2O稀释,防止发生爆炸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com