
【题目】摩尔盐[(NH4)2Fe(SO4)26H2O]是一种浅绿色晶体,广泛应用于电镀工业。为探 究其分解产物,某学习小组利用如图所示装置进行实验。
(查阅资料)隔绝空气加热至500°C时,摩尔盐能完全分解,分解产物中有铁氧化物, 硫氧化物,氨气和水蒸气等。

(1)对A装置加热前,先通一段时间N2的目的是_______。
(2)实验开始一段时间后,装置B中的现象为______。
(3)实验中观察到装置D始终无明显现象,装置C中和E中均产生白色沉淀。
①写出E中SO2与H2O2发生反应的化学方程式:_______。
②甲同学根据C中产生白色沉淀现象判断产物中一定含有SO3。请对甲同学的判断作出评价,并说明理由:_____。
(4)实验结束后,装置A中的固体变为红棕色,请补充完整检验该残留固体中是否含 FeO或Fe3O4的实验方案:取A中少量残留固体,加入稀硫酸使其完全溶解,向 溶液中滴加 ________,若观察到 ______,说明残留固体中不含FeO和Fe3O4。(提供的试剂有:NaOH溶液、氯水、硫氰化钾溶液、酸性高锰酸钾溶液)
【答案】排尽装置内的空气,防止氧气干扰 B中白色固体变蓝 SO2 + H2O2 =H2SO4 甲同学的判断不正确。若摩尔盐分解产生的NH3溶于C瓶,溶液呈碱性,则可能生成BaSO3沉淀 少量酸性高锰酸钾溶液 溶液紫色未褪去
【解析】
由题给实验装置图可知,装置A为摩尔盐受热分解装置,装置B为水的检验装置,装置C中盐酸吸收氨气,氯化钡用于检验三氧化硫,装置D中氯化钡用于证明三氧化硫被完全吸收,防止三氧化硫干扰二氧化硫的检验,装置E中双氧水用于氧化二氧化硫,氯化钡用于证明二氧化硫生成。
(1)对A装置加热前,先通一段时间N2的目的是排尽装置内的空气,防止氧气干扰实验,故答案为:排尽装置内的空气,防止氧气干扰;
(2)装置B无水硫酸铜是检验分解产物水,所以看到的现象为白色固体变蓝色,故答案为:B中白色固体变蓝色;
(3)①装置E中SO2与H2O2发生氧化还原反应生成硫酸,反应的化学方程式为SO2 + H2O2 =H2SO4,故答案为:SO2 + H2O2 =H2SO4;
②装置C中盐酸吸收氨气,若盐酸不足,极易溶于水的氨气溶于水使溶液呈碱性,二氧化硫也能与氯化钡反应生成亚硫酸钡表示沉淀,则甲同学的判断不正确,故答案为:甲同学的判断不正确。若摩尔盐分解产生的NH3溶于C瓶,溶液呈碱性,则可能生成BaSO3沉淀;
(4)若A中少量残留固体完全溶于稀硫酸所得溶液中不含有亚铁离子,则说明残留固体中不含FeO和Fe3O4,由提供的试剂可知,向所得溶液中滴加酸性高锰酸钾溶液,溶液紫色未褪去,说明不含有亚铁离子,故答案为:少量酸性高锰酸钾溶液;溶液紫色未褪去;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室要配制1000 mL 2 mol/L NaOH溶液,请回答下列问题:
(1)下面是几种实验中常用的仪器:
A. 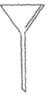 B.
B. ![]() C.
C.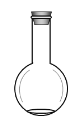 D.
D.![]()
①写出仪器A的名称__________
②配制过程中不需要使用的化学仪器有______(填仪器的字母)。
(2)用托盘天平称取氢氧化钠,其质量为______g。
(3)下列主要操作步骤的正确顺序是_________(填序号)。
①称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1-2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③待冷却至室温后,将溶液转移到100 mL 容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)下列情况中,会使所配溶液浓度偏高的是___________(填序号)。
A.定容时观察液面俯视 B.没有进行上述的操作步骤⑤
C.称量的氢氧化钠已潮解 D.容量瓶使用前内壁沾有水珠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有丙炔和氢气的混合气体5L,在催化剂作用下,经充分反应后得到的气体的体积为V(所有体积均在同温同压下测定)。
(1)若将上述5L气体在氧气中完全燃烧生成二氧化碳和水,消耗同温同压下氧气的体积V(O2)为___(取值范围)。
(2)若氢气的体积为1L,反应后的体积V=___L。
(3)若氢气在混合气体中的体积分数为x,试用x表示反应后的体积V=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液X中只可能溶有Na+、Mg2+、Al3+、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种离子。某同学对该溶液进行了如下实验:
中的若干种离子。某同学对该溶液进行了如下实验:
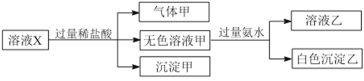
下列判断正确的是
A.气体甲一定是纯净物B.沉淀甲是硅酸和硅酸镁的混合物
C.Na+、![]() 和
和![]() 一定存在于溶液X中D.
一定存在于溶液X中D.![]() 和
和![]() 一定不存在于溶液X中
一定不存在于溶液X中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究含硫物质的循环,是能源开发和利用的重要途径之一。
(1)研究人员利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
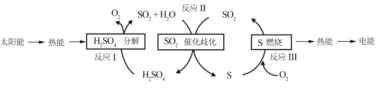
①反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJmol -1
反应Ⅲ:S(s)+O2(g) = SO2(g) ΔH3=-297 kJmol -1
反应Ⅱ的热化学方程式为________。
②对于反应Ⅱ,将投料比(n(SO2):n(H2O))为 3:2 的混合气体充入恒容的密闭容器中, 在不同压强下,H2SO4 在平衡体系中物质的量分数随温度的变化关系如下图所示。下列说法不正确的是___
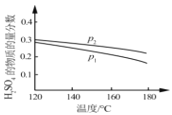
A.p2>p1,反应Ⅱ的ΔS < 0
B.使用合适催化剂可以提高 H2SO4 在平衡体系中物质的量分数
C.其他条件相同时,投料比(n(SO2):n(H2O))改变为 2:1,可提高 SO2 的平衡转化率
D.当容器内气体的密度不变时,可判断反应达到平衡状态
E.温度升高,有利于反应速率加快,SO2 的平衡转化率提高,K 值变小
(2)“硫碘循环”法是分解水制氢气的研究热点,涉及下列三个反应:
反应A:SO2(g) + I2(aq) + 2H2O(l) = 2HI(aq) + H2SO4(aq)
反应B:2HI(g) H2(g) + I2(g)
反应C:2H2SO4(g) 2H2O(g) + 2SO2(g) + O2(g)
①某温度下将 1mol HI 充入密闭容器中发生反应B,达到第 1 次平衡后,用选择性膜完全分离出 H2,达到第 2 次平衡后再次分离H2,重复多次,平衡时 n(HI)如下表:
达到平衡的次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 | 第 5 次 | …… |
n(HI)/mol | 0.78 | 0.67 | 0.60 | 0.55 | 0.51 | …… |
归纳出分离 H2 的次数对 HI 转化率的影响________。第 2 次平衡时 I2 的物质的量为 n(I2)=_____mol;
②反应 A 发生时,溶液中同时存在以下化学平衡: I2(aq) + I(aq)![]() (aq),其反应速率极快且平衡常数很大。现将 1mol SO2 缓缓通入含 1 mol I2 的水溶液中恰好完全反应。请在下图中画出溶液中
(aq),其反应速率极快且平衡常数很大。现将 1mol SO2 缓缓通入含 1 mol I2 的水溶液中恰好完全反应。请在下图中画出溶液中![]() 的物质的量 n( I3- )随反应时间 t 变化的曲线图____。
的物质的量 n( I3- )随反应时间 t 变化的曲线图____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2 mol·L1H2(g)、0.5mol·L1 I2(g)及0.3mol·L1HI(g),则下列说法中正确的是
2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2 mol·L1H2(g)、0.5mol·L1 I2(g)及0.3mol·L1HI(g),则下列说法中正确的是
A.反应正好达到平衡
B.反应向左进行
C.反应向某方向进行一段时间后K<57.0
D.反应向某方向进行一段时间后c(H2)<0.2mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,属于吸热反应的是( )
①液态水的汽化 ②将胆矾加热变为白色粉末
③浓硫酸稀释 ④KCl03分解制氧气
⑤生石灰跟水反应生成熟石灰
⑥CaCO3高温分解⑦CO2+C![]() 2CO
2CO
⑧Ba(OH)2·8H2O与固体NH4Cl混合
⑨C(s)+H2O(g)![]() CO(g)+H2(g)⑩Al与盐酸反应
CO(g)+H2(g)⑩Al与盐酸反应
A. ②③④⑤⑥⑦⑧⑨ B.②④⑥⑦⑧⑨ C.②④⑥⑧ D.②③④⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(气)+5O2(气)![]() 4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率υ (X)(反应物的消耗速率或产物的生成速率)可表示为( )
4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率υ (X)(反应物的消耗速率或产物的生成速率)可表示为( )
A. υ(NH3)=0.0100mol·L-1·s-1B. υ(O2)=0.0010 mol·L-1·s-1
C. υ(NO)=0.0010 mol·L-1·s-1D. υ(H2O)=0.045 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+![]() O2(g)=SO2(g)+H2O(g) ΔH1 ②2H2S(g)+SO2(g)=
O2(g)=SO2(g)+H2O(g) ΔH1 ②2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) ΔH2
S2(g)+2H2O(g) ΔH2
③H2S(g)+![]() O2(g)=S(g)+H2O(g) ΔH3 ④2S(g)=S2(g) ΔH4
O2(g)=S(g)+H2O(g) ΔH3 ④2S(g)=S2(g) ΔH4
则ΔH4的正确表达式为
A.ΔH4=![]() (ΔH1+ΔH2-3ΔH3)B.ΔH4=
(ΔH1+ΔH2-3ΔH3)B.ΔH4=![]() (3ΔH3-ΔH1-ΔH2)
(3ΔH3-ΔH1-ΔH2)
C.ΔH4=![]() (ΔH1+ΔH2-3ΔH3)D.ΔH4=
(ΔH1+ΔH2-3ΔH3)D.ΔH4=![]() (ΔH1-ΔH2-3ΔH3)
(ΔH1-ΔH2-3ΔH3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com