
【题目】己知A是气态烃,完全燃烧时产生的CO2和,H2O的物质的量之比为1:1,A的相对分子量小于30。在如图所示的变化中,中间产物C跟葡萄糖一样也能银新制的Cu(OH)2发生反应产生砖红色沉淀,E有香味,F是高分子化合物(反应条件未写出)。
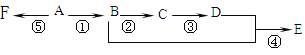
写出下列各步变化的化学方程式及反应类型。
反应①______;_______________
反应②______;________________
反应④______;___________________
反应⑤______;________________
【答案】CH2==CH2+H2O→CH3CH2OH 加成反应 2CH3CH2OH+O2→2CH3CHO+2H2O 氧化反应 CH3COOH+C2H5OH![]() CH3COOC2H5+H2O 取代反应(酯化反应) nCH2=CH2→
CH3COOC2H5+H2O 取代反应(酯化反应) nCH2=CH2→![]() 加聚反应
加聚反应
【解析】
A是气态烃,完全燃烧时产生的CO2和H2O的物质的量之比为1:1,所以A中C、H原子个数比为1:2,A的相对分子量小于30,所以A是乙烯;中间产物C跟葡萄糖一样也能跟新制的Cu(OH)2发生反应产生砖红色沉淀,能和新制氢氧化铜悬浊液产生砖红色沉淀说明C含有醛基,所以C是乙醛,则B是乙醇;E有香味,说明E中含有酯基,羧酸和醇反应生成酯,所以D是乙酸;F是高分子化合物,乙烯发生加聚反应生成聚乙烯,所以F是聚乙烯。反应①:乙烯和水在催化剂条件下发生加成反应生成乙醇,所以反应①的方程式为:CH2 =CH2+H2O→CH3CH2OH;反应②:在铜或银作催化剂、加热条件下,乙醇被氧气氧化生成乙醛,所以反应②的方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;反应④:在浓硫酸作催化剂、加热条件下,乙酸和乙醇反应酯化反应生成乙酸乙酯,反应方程式为:CH3COOH+C2H5OH
2CH3CHO+2H2O;反应④:在浓硫酸作催化剂、加热条件下,乙酸和乙醇反应酯化反应生成乙酸乙酯,反应方程式为:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O;反应⑤:在一定条件下,乙烯发生加聚反应生成聚乙烯,反应方程式为:n CH2=CH2
CH3COOC2H5+H2O;反应⑤:在一定条件下,乙烯发生加聚反应生成聚乙烯,反应方程式为:n CH2=CH2![]()
![]() ;故答案为:CH2 =CH2+H2O→CH3CH2OH,加成反应;2CH3CH2OH+O2
;故答案为:CH2 =CH2+H2O→CH3CH2OH,加成反应;2CH3CH2OH+O2![]() 2CH3CHO+2H2O,氧化反应;CH3COOH+C2H5OH
2CH3CHO+2H2O,氧化反应;CH3COOH+C2H5OH![]() CH3COOC2H5+H2O,酯化反应;n CH2=CH2
CH3COOC2H5+H2O,酯化反应;n CH2=CH2![]()
![]() ,加聚反应。
,加聚反应。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)![]() 2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
其中正确的是:
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用氧化铝基废催化剂(主要成分为Al2O3,还含有少量Pd(钯)))回收硫酸铝及Pd的流程如下:
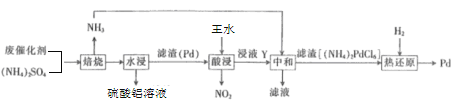
回答下列问题:
(1)将硫酸铝溶液蒸发浓缩后,冷却得到十八水合硫酸铝固体,该固体的化学式为___。
(2)焙烧时Al2O3与(NH4)2SO4反应的化学方程式为___。
(3)王水是浓硝酸和浓盐酸按体积比为___的混合物。王水不稳定,加热时能生成亚硝酰氯(NOCl)和氯气,该反应的化学方程式为___。
(4)浸液Y中含Pd元素的溶质是H2PdCl6(氯钯酸),则“酸浸”时反应的化学方程式为___。
(5)若“热还原”中得到的固体只有Pd,每生成1molPd时生成的气体的物质的量为___。
(6)Pd是优良的储氢金属,其储氢原理为2Pd(s)+xH2(g)═2PdHx(s),其中x的最大值为0.8。已知:Pd的密度为12gcm﹣3,则21.2cm3Pd能储存标准状况下H2的最大体积为___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲氧基肉桂酸乙基己酯(图中J)是一种理想的防晒剂,能有效吸收紫外线,安全性良好。其合成线路图如下:
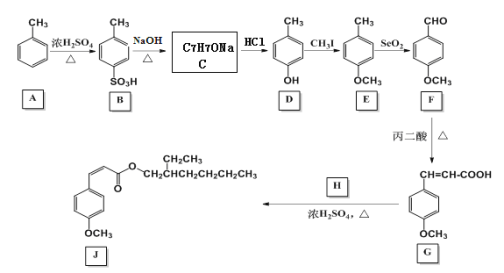
回答下列问题:
(1)由A生成B的反应类型为___。有机物E的分子式为___。丙二酸的结构简式为___。
(2)C的结构简式为___。
(3)H的结构简式为___。
(4)G与氢气反应可得X(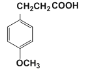 )。X有多种同分异构体,其中同时满足下列条件同分异构体的结构简式为:___。
)。X有多种同分异构体,其中同时满足下列条件同分异构体的结构简式为:___。
①核磁共振氢谱有四种峰;②与FeCl3溶液能发生显色反应,且1mol该物质恰好能与3molNaOH完全反应。
(5)以乙醇和丙二酸为原料合成聚巴豆酸乙酯 ,请补充完成以下合成路线(无机试剂可任选)。
,请补充完成以下合成路线(无机试剂可任选)。
____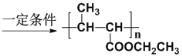
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙是一种白色固体,微溶于冷水,不溶于乙醇,化学性质与过氧化钠类似。某学习小组设计在碱性环境中利用CaCl2与H2O2反应制取CaO2·8H2O,装置如图所示:
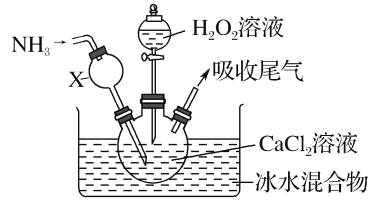
回答下列问题:
(1)小组同学查阅文献得知:该实验用质量分数为20%的H2O2溶液最为适宜。市售H2O2溶液的质量分数为30%。该小组同学用市售H2O2溶液配制约20%的H2O2溶液的过程中,使用的玻璃仪器除玻璃棒、胶头滴管外,还有___。
(2)仪器X的主要作用除导气外,还具有的作用是___。
(3)在冰水浴中进行的原因是___。
(4)实验时,在三颈烧瓶中析出CaO2·8H2O晶体,总反应的离子方程式为___。
(5)反应结束后,经过滤、洗涤、低温烘干获得CaO2·8H2O。下列试剂中,洗涤CaO2·8H2O的最佳选择是____。
A.无水乙醇 B.浓盐酸 C.Na2SO3溶液 D.CaCl2溶液
(6)若CaCl2原料中含有Fe3+杂质,Fe3+催化分解H2O2,会使H2O2的利用率明显降低。反应的机理为:
①Fe3+ +H2O2=Fe2++H++HOO·
②H2O2+X=Y +Z+W(已配平)
③Fe2++·OH=Fe3++OH-
④H+ +OH-=H2O
根据上述机理推导步骤②中的化学方程式为___。
(7)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙具有____的性质。
A.与水缓慢反应供氧 B.能吸收鱼苗呼出的CO2气体
C.能是水体酸性增强 D.具有强氧化性,可杀菌灭藻
(8)将所得CaO2·8H2O晶体加热到150~160℃,完全脱水后得到过氧化钙样品。
该小组测定过氧化钙样品中CaO2的纯度的方法是:准确称取0.4000g过氧化钙样品,400℃以上加热至完全分解成CaO和O2(设杂质不产生气体),得到33.60mL(已换算为标准状况)气体。
则:所得过氧化钙样品中CaO2的纯度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、N、M六种主族元素,它们在周期表中位置如图所示,下列说法不正确的是

A. 原子半径:Y>Z>W
B. 单质的还原性:X>Y
C. 溴与元素M同主族,最高价氧化物的水化物的酸性比M的强
D. 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质不能实现直接转化的是( )
A.C→CO2→NaHCO3→Na2CO3
B.Al→Al(OH)3→Al2O3→NaAlO2
C.Na→NaOH→Na2CO3→NaHCO3
D.Na→Na2O2→Na2CO3→NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A.中性溶液中:Fe3+、NH4+、Br、HCO3-
B.澄清透明的溶液中:Na+、Cu2+、NO3-、Cl-
C.c(OH-)<![]() 的溶液中:Na+、Ca2+、ClO-、F-
的溶液中:Na+、Ca2+、ClO-、F-
D.1mo/L的KNO3溶液中:H+、Fe2+、SCN-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个真空恒容密闭容器中盛有1molPCl5,加热到200℃时发生如下反应:PCl5(气) ![]() PCl3(气)+Cl2(气),反应达到平衡时,混合气体中PCl5所占体积分数为M%. 若在同一温度和同一容器中,最初投入是2molPCl5,反应达平衡时,混合气体中PCl5所占体积分数为N%.则M和N的关系 ( )
PCl3(气)+Cl2(气),反应达到平衡时,混合气体中PCl5所占体积分数为M%. 若在同一温度和同一容器中,最初投入是2molPCl5,反应达平衡时,混合气体中PCl5所占体积分数为N%.则M和N的关系 ( )
A. 大于B. 小于C. 等于D. 不能肯定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com