
ΓΨΧβΡΩΓΩΙΛ“Β…œάϊ”Ο―θΜ·¬ΝΜυΖœ¥ΏΜ·ΦΝΘ®÷ς“Σ≥…Ζ÷ΈΣAl2O3Θ§ΜΙΚ§”–…ΌΝΩPd(νΌ)Θ©Θ©ΜΊ ’ΝρΥα¬ΝΦΑPdΒΡΝς≥Χ»γœ¬ΘΚ
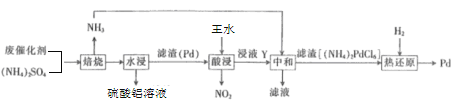
ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©ΫΪΝρΥα¬Ν»ή“Κ’τΖΔ≈®ΥθΚσΘ§ά以ΒΟΒΫ °ΑΥΥ°ΚœΝρΥα¬ΝΙΧΧεΘ§ΗΟΙΧΧεΒΡΜ·―ß ΫΈΣ___ΓΘ
Θ®2Θ©±Κ…’ ±Al2O3”κ(NH4)2SO4Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ___ΓΘ
Θ®3Θ©ΆθΥ° «≈®œθΥαΚΆ≈®―ΈΥαΑ¥ΧεΜΐ±»ΈΣ___ΒΡΜλΚœΈοΓΘΆθΥ°≤ΜΈ»Ε®Θ§Φ”»» ±Ρή…ζ≥…―«œθθΘ¬»(NOCl)ΚΆ¬»ΤχΘ§ΗΟΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ___ΓΘ
Θ®4Θ©Ϋΰ“ΚY÷–Κ§Pd‘ΣΥΊΒΡ»ή÷ «H2PdCl6(¬»νΌΥα)Θ§‘ρΓΑΥαΫΰΓ± ±Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ___ΓΘ
Θ®5Θ©»τΓΑ»»ΜΙ‘≠Γ±÷–ΒΟΒΫΒΡΙΧΧε÷Μ”–PdΘ§ΟΩ…ζ≥…1molPd ±…ζ≥…ΒΡΤχΧεΒΡΈο÷ ΒΡΝΩΈΣ___ΓΘ
Θ®6Θ©Pd «”≈ΝΦΒΡ¥Δ«βΫπ τΘ§Τδ¥Δ«β‘≠άμΈΣ2PdΘ®sΘ©+xH2Θ®gΘ©®T2PdHxΘ®sΘ©Θ§Τδ÷–xΒΡΉν¥σ÷ΒΈΣ0.8ΓΘ“―÷ΣΘΚPdΒΡΟήΕ»ΈΣ12gcm©¹3Θ§‘ρ21.2cm3PdΡή¥Δ¥φ±ξΉΦΉ¥Ωωœ¬H2ΒΡΉν¥σΧεΜΐΈΣ___LΓΘ
ΓΨ¥πΑΗΓΩAl2(SO4)3ΓΛ18H2O 3(NH4)2SO4+Al2O3![]() Al2(SO4)3+6NH3Γϋ+3H2OΓϋ 1ΘΚ3 HNO3(≈®) +3HCl(≈®)
Al2(SO4)3+6NH3Γϋ+3H2OΓϋ 1ΘΚ3 HNO3(≈®) +3HCl(≈®)![]() NOClΓϋ+Cl2Γϋ+2H2O Pd+6HCl+4HNO3=H2PdCl6+4NO2Γϋ+4H2O 8mol 21.504
NOClΓϋ+Cl2Γϋ+2H2O Pd+6HCl+4HNO3=H2PdCl6+4NO2Γϋ+4H2O 8mol 21.504
ΓΨΫβΈωΓΩ
Ζœ¥ΏΜ·ΦΝΚΆΝρΥαοßΖ¥”Π…ζ≥…Α±ΤχΚΆΝρΥα¬ΝΘ§¬Υ‘ϋPdΚΆΆθΥ°Ζ¥”ΠΗυΨί―θΜ·ΜΙ‘≠Ζ¥”Πά¥ ι–¥ΖΫ≥Χ ΫΘ§“‘ΦΑΆθΥ°œύΜΞΖ¥”ΠΘ§άϊ”Ο“―÷Σ–≈œΔ–¥≥ω(NH4)2PdCl6 ”κH2Ζ¥”ΠΒΟ≥ω…ζ≥…ΤχΧεΒΡΈο÷ ΒΡΝΩΘ§‘Όάϊ”ΟΙΊœΒ ΫΦΤΥψPdΈϋ ’«βΤχΒΡΧεΜΐΓΘ
Δ≈ΫΪΝρΥα¬Ν»ή“Κ’τΖΔ≈®ΥθΚσΘ§ά以ΒΟΒΫ °ΑΥΥ°ΚœΝρΥα¬ΝΙΧΧεΘ§ΫαΨßΥ°–¥‘ΎΉνΚσΘ§≤Δ“Σ”Ο–Γ‘≤ΒψΗτΩΣΘ§ΗΟΙΧΧεΒΡΜ·―ß ΫΈΣAl2(SO4)3ΓΛ18H2OΘ§
Ι ¥πΑΗΈΣΘΚAl2(SO4)3ΓΛ18H2OΘΜ
ΔΤΗυΨί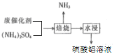 «ΑΚσΝΣœΒΘ§ΒΟ≥ω±Κ…’ ±Al2O3”κ(NH4)2SO4Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ3(NH4)2SO4+Al2O3
«ΑΚσΝΣœΒΘ§ΒΟ≥ω±Κ…’ ±Al2O3”κ(NH4)2SO4Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ3(NH4)2SO4+Al2O3![]() Al2(SO4)3+6NH3Γϋ+3H2OΓϋΘ§
Al2(SO4)3+6NH3Γϋ+3H2OΓϋΘ§
Ι ¥πΑΗΈΣΘΚ3(NH4)2SO4+Al2O3![]() Al2(SO4)3+6NH3Γϋ+3H2OΓϋΘΜ
Al2(SO4)3+6NH3Γϋ+3H2OΓϋΘΜ
Δ«ΆθΥ° «≈®œθΥαΚΆ≈®―ΈΥαΑ¥ΧεΜΐ±»ΈΣ1:3ΒΡΜλΚœΈοΓΘΆθΥ°≤ΜΈ»Ε®Θ§Φ”»» ±Ρή…ζ≥…―«œθθΘ¬»(NOCl)ΚΆ¬»ΤχΘ§HNO3(≈®)Μ·ΚœΦέΫΒΒΆ±δΈΣNOClΘ§‘ρ―ΈΥαΜ·ΚœΦέ…ΐΗΏ±δΈΣ¬»ΤχΘ§“ρ¥ΥΗΟΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣHNO3(≈®) +3HCl(≈®)![]() NOClΓϋ+Cl2Γϋ+2H2OΘ§
NOClΓϋ+Cl2Γϋ+2H2OΘ§
Ι ¥πΑΗΈΣΘΚHNO3(≈®) +3HCl(≈®)![]() NOClΓϋ+Cl2Γϋ+2H2OΘΜ
NOClΓϋ+Cl2Γϋ+2H2OΘΜ
Δ»Ϋΰ“ΚY÷–Κ§Pd‘ΣΥΊΒΡ»ή÷ «H2PdCl6(¬»νΌΥα)Θ§‘ΌΗυΨίΆΦ÷––≈œΔΘ§‘Ύ…ζ≥…H2PdCl6(¬»νΌΥα)ΒΡΆ§ ±ΜΙ…ζ≥…ΝΥΕΰ―θΜ·ΒΣΘ§“ρ¥ΥΓΑΥαΫΰΓ± ±Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣPd+6HCl+4HNO3 = H2PdCl6+4NO2Γϋ+4H2OΘ§
Ι ¥πΑΗΈΣΘΚPd+6HCl+4HNO3=H2PdCl6+4NO2Γϋ+4H2OΘΜ
Δ…»τΓΑ»»ΜΙ‘≠Γ±÷–ΒΟΒΫΒΡΙΧΧε÷Μ”–PdΘ§ΗυΨί(NH4)2PdCl6 + 2H2 = Pd + 6HClΓϋ+ 2NH3ΓϋΖ¥”ΠΘ§ΟΩ…ζ≥…1mol Pd ±…ζ≥…ΒΡΤχΧεΒΡΈο÷ ΒΡΝΩΈΣ8 molΘ§
Ι ¥πΑΗΈΣΘΚ8 molΘΜ
Δ Pd «”≈ΝΦΒΡ¥Δ«βΫπ τΘ§Τδ¥Δ«β‘≠άμΈΣ2PdΘ®sΘ©+xH2Θ®gΘ©®T2PdHxΘ®sΘ©Θ§Τδ÷–xΒΡΉν¥σ÷ΒΈΣ0.8ΓΘ“―÷ΣΘΚPdΒΡΟήΕ»ΈΣ12gcm©¹3Θ§‘ρ21.2cm3Pd÷ ΝΩm = 21.2cm3ΓΝ12gcm©¹3=254.4gΘ§ΤδΈο÷ ΒΡΝΩ![]() Θ§
Θ§
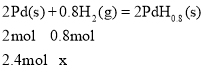
ΫβΒΟx = 2.4mol0.8molΓ¬2mol=0.96 mol
Ρή¥Δ¥φ±ξΉΦΉ¥Ωωœ¬H2ΒΡΉν¥σΧεΜΐΈΣ![]() Θ§
Θ§
Ι ¥πΑΗΈΣ21.504 LΓΘ


 Ά®≥«―ßΒδΡ§–¥Ρή ÷œΒΝ–¥πΑΗ
Ά®≥«―ßΒδΡ§–¥Ρή ÷œΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ÷–Ιζ¥ΪΆ≥ΈΡΜ·÷–Αϋά®–μΕύΩΤΦΦ÷Σ ΕΓΘœ¬Ν–Ι≈”ο÷–≤Μ…φΦΑΜ·―ß±δΜ·ΒΡ «
«ßΧ‘ΆρδθΥδ–ΝΩύΘ§¥ΒΨΓΩώ…≥ ΦΒΫΫπ |
ΑΨΒ®Ζ·(CuSO4ΓΛ5H2O) ΧζΗΣΘ§ΨΟ÷°“ύΜ·ΈΣΆ≠ |
Ζ≤ ·Μ“(CaCO3)Θ§ Ψ≠ΜπΖΌΝΕΈΣ”Ο |
ΒΛ…Α(HgS)…’÷°≥…Υ°“χΘ§Μΐ±δ”÷≥…ΒΛ…Α |
A | B | C | D |
A. A B. B C. C D. D
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ―θΜ·ΜΙ‘≠ «“Μάύ÷Ί“ΣΒΡΖ¥”ΠΓΘ
Θ®1Θ©Ρ≥Ά§―ß–¥≥ω“‘œ¬»ΐΗωΜ·―ßΖΫ≥Χ Ϋ(Έ¥≈δΤΫ)
ΔΌN2O4ΘΪH2OΓζHNO3ΘΪHNO2 ΔΎNOΘΪHNO3ΓζN2O3ΘΪH2O ΔέNH3ΘΪNOΓζHNO2ΘΪH2O
Τδ÷–Ρψ»œΈΣ“ΜΕ®≤ΜΩ…Ρή Βœ÷ΒΡ «Θ®Χν¥ζΚ≈Θ©____________ΘΜ
Θ®2Θ©“‘œ¬Ζ¥”Π÷–H2O2ΫωΧεœ÷ΜΙ‘≠–‘ΒΡ «Θ®Χν¥ζΚ≈Θ©____________Θ§H2O2Φ»Χεœ÷―θΜ·–‘”÷Χεœ÷ΜΙ‘≠–‘ΒΡ «Θ®Χν¥ζΚ≈Θ©____________Θ§¥”Ζ¥”Π÷–≈–ΕœH2O2ΓΔAg2OΓΔK2CrO4―θΜ·–‘”…«ΩΒΫ»θΒΡΥ≥–ρ «_______________ΘΜ
AΘ°H2O2+2Fe2++2H+=2Fe3++2H2O
BΘ°2H2O2=2H2O+O2Γϋ
CΘ°Ag2O+H2O2=2Ag+O2Γϋ+H2O
DΘ°3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
EΘ°H2O2+MnSO4=MnO2+H2SO4
Θ®3Θ©”ΟΓΑΥΪœΏ«≈Ζ®Γ±±ξΟς“‘œ¬Ζ¥”Π÷–ΒγΉ”ΉΣ“ΤΒΡΖΫœρΚΆ ΐΡΩ________Θ§»τΖ¥”Π÷–”–3.01ΓΝ1023ΗωΒγΉ”ΉΣ“ΤΘ§‘ρ±Μ―θΜ·ΒΡΜΙ‘≠ΦΝΒΡΈο÷ ΒΡΝΩΈΣ___________ΓΘ
2KMnO4ΘΪ16HClΘ®≈®Θ©=2KClΘΪ2MnCl2ΘΪ5Cl2ΓϋΘΪ8H2O
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΈΣ±»Ϋœ![]() ΚΆ
ΚΆ![]() Ε‘
Ε‘![]() Ζ÷ΫβΖ¥”ΠΒΡ¥ΏΜ·–ßΙϊΘ§ΦΉΓΔ““ΝΫΈΜΆ§―ßΖ÷±π…ηΦΤΝΥ»γΆΦ÷–ΦΉΓΔ““Υυ ΨΒΡ Β―ιΓΘœ¬Ν––π ω÷–≤Μ’ΐ»ΖΒΡ «
Ζ÷ΫβΖ¥”ΠΒΡ¥ΏΜ·–ßΙϊΘ§ΦΉΓΔ““ΝΫΈΜΆ§―ßΖ÷±π…ηΦΤΝΥ»γΆΦ÷–ΦΉΓΔ““Υυ ΨΒΡ Β―ιΓΘœ¬Ν––π ω÷–≤Μ’ΐ»ΖΒΡ «![]() ΓΓΓΓ
ΓΓΓΓ![]()

A. ΆΦΦΉΥυ Ψ Β―ιΩ…Ά®ΙΐΙέ≤λ≤ζ…ζΤχ≈ίΒΡΩλ¬ΐά¥±»ΫœΖ¥”ΠΥΌ¬ ΒΡ¥σ–Γ
B. »τΆΦΦΉΥυ Ψ Β―ι÷–Ζ¥”ΠΥΌ¬ ΈΣΔΌΘΨΔΎΘ§‘ρΥΒΟς![]() “ΜΕ®±»
“ΜΕ®±»![]() Ε‘
Ε‘![]() Ζ÷ΫβΒΡ¥ΏΜ·–ßΙϊΚΟ
Ζ÷ΫβΒΡ¥ΏΜ·–ßΙϊΚΟ
C. ”ΟΆΦ““Υυ ΨΉΑ÷Ο≤βΕ®Ζ¥”ΠΥΌ¬ Θ§Ω…≤βΕ®Ζ¥”Π≤ζ…ζΒΡΤχΧεΧεΜΐΦΑΖ¥”Π ±Φδ
D. ΈΣΦλ≤ιΆΦ““Υυ ΨΉΑ÷ΟΒΡΤχΟή–‘Θ§Ω…ΙΊ±’Ζ÷“Κ¬©ΕΖΒΡΜν»ϊΘ§ΫΪΉΔ…δΤςΜν»ϊά≠≥ω“ΜΕ®ΨύάκΘ§“ΜΕΈ ±ΦδΚσΥ…ΩΣΜν»ϊΘ§Ιέ≤λΜν»ϊ «ΖώΜΊΒΫ‘≠ΈΜ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ¬»Φν≥ßΒγΫβ±ΞΚΆ ≥―ΈΥ°÷Τ»ΓNaOHΒΡΙΛ“’Νς≥Χ Ψ“βΆΦ»γœ¬ΘΚ
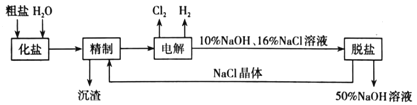
“άΨί…œΆΦΘ§Άξ≥…œ¬Ν–ΧνΩ’ΘΚ
Θ®1Θ©¥”ΚΘΥ°÷–Μώ»Γ¥÷―ΈΒΡΖΫΖ® «___ΓΘ
Θ®2Θ©ΓΑΨΪ÷ΤΓ±ΙΛ–ρ÷–Θ§”ϊ≥ΐ»Ξ¥÷―ΈΥ°÷–ΒΡCa2+ΓΔMg2+ΦΑSO42-Θ§Ω…Ϋχ––ΒΡ≤ΌΉς”–ΘΚ
A. Ιΐ¬Υ
B. Φ”ΙΐΝΩBaCl2»ή“Κ
C. Φ” ΝΩœΓ―ΈΥα
D. Φ”ΙΐΝΩNaOH»ή“Κ
E. Φ”ΙΐΝΩNa2CO3»ή“Κ
ΔΌ’ΐ»Ζ≤ΌΉςΒΡΥ≥–ρ «___(ΧνΉ÷ΡΗ)ΓΘ
ΔΎ≤ΌΉςBΒΡΡΩΒΡ «___
Δέ≤ΌΉςCΒΡΡΩΒΡ «___
Δή≤ΌΉςD÷–ΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ «___
Δί¥Υ≤ΌΉς÷–ΒΡœΓ―ΈΥαΡήΖώ”ΟœΓœθΥα¥ζΧφ?____(ΧνΓΑΡήΓ±ΜρΓΑΖώΓ±)Θ§άμ”… «___ΓΘ
Θ®3Θ©Φλ―ιΓΑΒγΫβΓ±ΚσΒΡ»ή“Κ÷–»‘»ΜΚ§”–NaClΒΡΖΫΖ® «___Θ§Ιέ≤λΒΫΒΡœ÷œσ «___ΓΘ
Θ®4Θ©ΓΑΆ――ΈΓΑΙΛ–ρ÷–Θ§Ά®ΙΐΦ”»»≈®ΥθΓΔά以ΫαΨßΓΔ___ΒΡΖΫΖ®≥ΐ»ΞNaClΘ§ΗΟΖΫΖ®ΒΡ‘≠άμ «œύΆ§Έ¬Ε»œ¬NaCl”κNaOHΒΡ»ήΫβΕ»≤ΜΆ§Θ§‘ΎΗΟ≤ΌΉςΈ¬Ε»œ¬Θ§»ήΫβΕ»Ϋœ¥σΒΡ «___ΓΘ
Θ®5Θ©…œ ωΙΛ“’÷–Ω…―≠ΜΖ Ι”ΟΒΡΈο÷ «______ΓΘ(ΧνΜ·―ß Ϋ)ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ»γΆΦ «ΙΛ“Βάϊ”ΟΝβΟΨΩσ(÷ς“ΣΚ§MgCO3Θ§ΜΙΚ§”–Al2O3ΓΔFeCO3‘”÷ )÷Τ»Γ¬»Μ·ΟΨΒΡΙΛ“’Νς≥ΧΓΘ
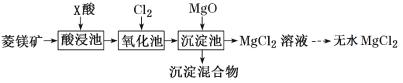
œ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «
A.ΥαΫΰ≥Ί÷–Φ”»κΒΡXΥα «œθΥα
B.―θΜ·≥Ί÷–Ά®»κ¬»ΤχΒΡΡΩΒΡ «ΫΪFe2+―θΜ·ΈΣFe3+
C.…ζ≥…ΒΡ≥ΝΒμΈοΈΣFe(OH)3ΚΆAl(OH)3
D.‘ΎΙΛ“Β…œ≥Θάϊ”ΟΒγΫβ»έ»Ύ¬»Μ·ΟΨΒΡΖΫΖ®÷Τ»ΓΫπ τΟΨ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–Ε‘œύΙΊ Β―ιΒΡ–π ωΖϊΚœ ¬ ΒΒΡ «
A.Χζ”κΥ°’τΤχ‘ΎΗΏΈ¬œ¬ΒΡΖ¥”Π≤ζΈοΈΣFe3O4ΚΆH2
B.œρ“Μ–Γ…’±≠÷–Ζ÷±πΦ”»κΒ»ΧεΜΐΒΡΥ°ΚΆΟΚ”ΆΘ§Τ§ΩΧΚσ‘ΌœρΗΟ…’±≠÷–ΜΚ¬ΐΒΊΦ”»κ“Μ¬ΧΕΙΝΘ¥σΒΡΫπ τΡΤΘ§Ω…ΡήΙέ≤λΒΫΒΡœ÷œσ «»γΆΦ

C.”ΟΫύΨΜΒΡ≤§ΥΩ’Κ»Γ¥ΐ≤β“ΚΘ§÷Ο”ΎΨΤΨΪΒΤΜπ―φ…œΉΤ…’Θ§Ιέ≤λΒΫΜπ―φ≥ ΜΤ…ΪΘ§‘ρ±μΟς¥ΐ≤β“Κ÷–“ΜΕ®Κ§”–Na+Εχ≤ΜΚ§K+
D.”Οέαέω«·Φ–ΉΓ¬Ν≤≠‘ΎΨΤΨΪΒΤ…œΦ”»»÷Ν»έΜ·Θ§«α«αΜΈΕ·Θ§”–“ΚΧ§ΒΡ¬ΝΒΈ¬δœ¬ά¥
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΦΚ÷ΣA «ΤχΧ§ΧΰΘ§Άξ»Ϊ»Φ…’ ±≤ζ…ζΒΡCO2ΚΆΘ§H2OΒΡΈο÷ ΒΡΝΩ÷°±»ΈΣ1ΘΚ1Θ§AΒΡœύΕ‘Ζ÷Ή”ΝΩ–Γ”Ύ30ΓΘ‘Ύ»γΆΦΥυ ΨΒΡ±δΜ·÷–Θ§÷–Φδ≤ζΈοCΗζΤœΧ―Χ«“Μ―υ“≤Ρή“χ–¬÷ΤΒΡCu(OH)2ΖΔ…ζΖ¥”Π≤ζ…ζΉ©Κλ…Ϊ≥ΝΒμΘ§E”–œψΈΕΘ§F «ΗΏΖ÷Ή”Μ·ΚœΈο(Ζ¥”ΠΧθΦΰΈ¥–¥≥ω)ΓΘ
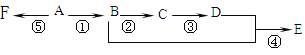
–¥≥ωœ¬Ν–Ης≤Ϋ±δΜ·ΒΡΜ·―ßΖΫ≥Χ ΫΦΑΖ¥”Πάύ–ΆΓΘ
Ζ¥”ΠΔΌ______ΘΜ_______________
Ζ¥”ΠΔΎ______ΘΜ________________
Ζ¥”ΠΔή______ΘΜ___________________
Ζ¥”ΠΔί______ΘΜ________________
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–ΥΒΖ®÷–’ΐ»ΖΒΡ «
A.‘Ύ¥÷Ά≠ΒΡΨΪΝΕΙΐ≥Χ÷–Θ§»τΒγ¬Ζ÷–ΉΣ“Τ1 mol ΒγΉ”Θ§‘ρ―τΦΪ÷ ΝΩ“ΜΕ®Φθ…ΌΝΥ32 g
B.Ζ¥”Π8NH3(g)+6NO2(g)=7N2(g)+12H2O(g) ΠΛH<0Θ§‘ρΗΟΖ¥”Π“ΜΕ®ΡήΉ‘ΖΔΫχ––
C.1.2gΒΡΫπΗ’ ·ΚΆ12g ΒΡSiO2Ζ÷±πΚ§”–0.4molΒΡC-CΦϋ”κ0.4mol ΒΡSi-O Φϋ
D.≥ΘΈ¬œ¬Θ§œρNH4Cl»ή“Κ÷–Φ”»κ…ΌΝΩNaOHΙΧΧεΘ®»ή“ΚΈ¬Ε»ΟΜ”–±δΜ·Θ©Θ§»ή“Κ÷–![]() ΒΡ÷Β‘ω¥σ
ΒΡ÷Β‘ω¥σ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com