
【题目】随着我国汽车年销量的大幅增加,给空气环境造成了很大的污染。汽车尾气装置里,气体在催化剂表明吸附与解吸作用的过程如图所示,下列说法正确的是
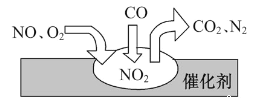
A. 反应中CO为氧化剂,N2为氧化产物
B. 催化转化总反应为2NO+O2+4CO![]() 4CO2+N2
4CO2+N2
C. NO和O2必须在催化剂表面才能反应
D. 汽车尾气的主要污染成分包括CO、NO和N2
科目:高中化学 来源: 题型:
【题目】下图为五个椭圆交叉构成的图案,椭圆内分别写了C2H5OH、CO2、Fe2O3、FeCl3和NaOH五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号。请回答下列问题:

(1)两种物质混合能发生反应且都是电解质的是________(填分类标准代号,下同),两种物质都是氧化物的是________。
(2)分类标准代号A表示______________(多项选择)
a.两物质都是非电解质 b.两物质都是有机物
c.两物质都是含碳化合物 d.两物质都是氧化物
(3)上述五种物质中的某一物质能与某种强酸反应生成上述物质中的另一种物质,该反应的离子方程式为:__________________________________。
(4)用洁净的烧杯取25 mL蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质的饱和溶液,加热得红褐色胶体,该反应的化学方程式为: ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是混合物分离的实验,请回答有关问题
实验:通过蒸馏的方法除去自来水中含有的氯离子等杂质制取纯净水,如图所示
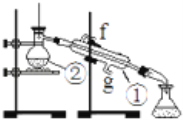
(1)写出下列仪器的名称:①________②________。
(2)若利用以上装置分离酒精和四氯化碳两种溶液的混合物,还缺少的仪器是________,图中装置中进水口是________。(填“f”或“g”)
(3)仪器①中常加入碎瓷片,这样做的目的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的为( )
A. 铜片插入硝酸银溶液中:Cu+Ag+= Cu2++Ag
B. 稀盐酸滴在石灰石上:CaCO3+H+ = Ca2++H2CO3
C. 氢氧化钡与稀硫酸反应:Ba2++OH-+H+ +SO42-=BaSO4↓+H2O
D. 氧化镁与盐酸反应 MgO+2H+=Mg2++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中,每生成1molAlN需转移3mol电子
C. AlN中氮元素的化合价为+3
D. CO是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了控制温室效应,各国科学家提出了不少方法和设想。有人根据液态二氧化碳气体的密度大于海水密度的事实,设想将二氧化碳液化后送入深海海底。以减少二氧化碳气体的浓度。为使二氧化碳液化,可采用的方法是
A. 减压、升温 B. 增压、升温 C. 减压、降温 D. 增压、降温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓硫酸和乙醇制乙烯的装置如图所示,对下列操作或现象描述正确的是( )
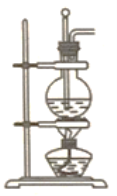
A. 圆底烧瓶中先加浓硫酸再加入乙醇
B. 实验得到的气体能使溴水褪色说明有乙烯生成
C. 反应中圆底烧瓶内会产生黑色固体
D. 用排水法或向下排空气法收集乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、在t℃时,某NaOH稀溶液中,c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=12,则:
(1)该温度下水的离子积常数KW=________。
(2)该NaOH溶液的物质的量浓度的精确值是________mol/L。
(3)在该温度下,将100 mL 0.1 mol/L的稀硫酸与100 mL 0.4 mol/L的NaOH溶液混合后,溶液的pH=________。
Ⅱ、现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水,请回答下列问题:
(4)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是 (填序号)___________。
(5)④、⑤、⑦、⑧四种溶液中NH![]() 浓度由大到小的顺序是 (填序号)_________________。
浓度由大到小的顺序是 (填序号)_________________。
(6)将③和④等体积混合后,混合液中各离子浓度关系正确的是________(填字母序号)。
A.c(Na+)=c(Cl-)>c(OH-)>c(NH![]() )
)
B.c(Na+)=0.1 mol/L
C.c(Na+)+c(NH![]() )=c(Cl-)+c(OH-)
)=c(Cl-)+c(OH-)
D.c(H+)>c(OH-)
Ⅲ、常温下,amol/L氯化铵溶液中加入等体积bmol/L氢氧化钠溶液,反应后混合液呈中性,求该温度下NH3·H2O的电离常数________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com