
 的系统命名是2,3-二甲基-1,3-戊二烯;
的系统命名是2,3-二甲基-1,3-戊二烯;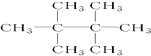 ,名称是2,2,3,3-四甲基丁烷;
,名称是2,2,3,3-四甲基丁烷; ;
; 的结构简式CH2=CH(CH3)COOHCH3.
的结构简式CH2=CH(CH3)COOHCH3. 分析 (1)该有机物为二烯烃,主链最长碳链含有5个C,编号从右到左,在2、3号C各含有1个甲基,双键在1、2、3、4号碳上;
(2)乙烷的一溴代物只有一种,然后用甲基取代乙烷中的6个H可以得到含有6个甲基,根据烷烃系统法命名;
(3)乙炔与氯化氢加成生成氯乙烯;
(4)①羟基中氧原子含有两个孤电子对、氢原子和氧原子之间共用一对电子;
②根据碳为4价补齐H得到的结构简式.
解答 解:(1)烯烃命名选取含有碳碳双键的最长碳链为主链,距离双键最近的一端为1号碳,该有机物为二烯烃,主链最长碳链含有5个C,编号从右到左,在2、3号C各含有1个甲基,双键在1、2、3、4号碳上,系统命名的名称为:2,3-二甲基-1,3-戊二烯,
故答案为:2,3-二甲基-1,3-戊二烯;
(2)乙烷结构简式为:CH3CH3,乙烷的一溴代物只有一种,用六个甲基取代乙烷分子中的6个H,分子式是C8H18,得到的有机物的结构简式为 ,该有机物主链最长碳链含有4个C,在2、3号C各含有2个甲基,系统命名的名称为:2,2,3,3-四甲基丁烷,
,该有机物主链最长碳链含有4个C,在2、3号C各含有2个甲基,系统命名的名称为:2,2,3,3-四甲基丁烷,
,
故答案为: ;2,2,3,3-四甲基丁烷;
;2,2,3,3-四甲基丁烷;
(3)乙炔与氯化氢加成反应的方程式:CH≡CH+HCl→CH2=CHCl,
故答案为:CH≡CH+HCl→CH2=CHCl;
(4)①羟基中氧原子最外层为7个电子,氢原子最外层2个电子,羟基的电子式为: ,
,
故答案为: ;
;
②补齐H得到的结构简式为CH2=CH(CH3)COOHCH3,
故答案为:CH2=CH(CH3)COOHCH3.
点评 本题考查了常见化学用语的书写方法,题目难度不大,注意掌握系统命名、结构简式、化学方程式、电子式等化学用语的概念及书写原则,试题培养了学生规范答题的能力.


科目:高中化学 来源: 题型:解答题
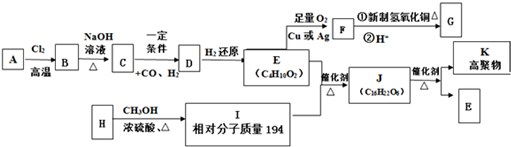
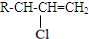
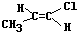 .
.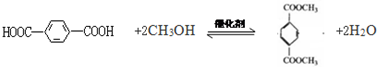 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A原子的最外层电子数比B原子的最外层电子数少 | |
| B. | 常温时,A能从盐酸中置换出氢气,而B不能反应 | |
| C. | B不能从溶液中置换出A | |
| D. | 1 mol A失去的电子比1 mol B失去的电子多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在金属区、非金属区交界线上,寻找具有半导体性能的材料 | |
| B. | 形成化合物种类最多的元素在第14列 | |
| C. | 第ⅡA族的右边是第ⅢB族,第ⅢA族的左边是第ⅡB族 | |
| D. | 某主族元素最高价氧化物对应的水化物的化学式为HnROm,其气态氢化物的化学式一定为H2m-nR或RH2m-n |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 C2H2 | B. | C2H6 C3H6 | C. | C2H4 C3H6 | D. | C2H4 C3H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

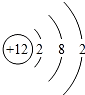 ,⑧
,⑧
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
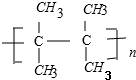 ,A中碳原子是(填“是”或者“不是”)都处在同一平面,A催化加氢后的物质用系统命名法命名名称是2,3-二甲基丁烷;在A的同系物中分子量最小的烃的电子式为CH2=CH2.
,A中碳原子是(填“是”或者“不是”)都处在同一平面,A催化加氢后的物质用系统命名法命名名称是2,3-二甲基丁烷;在A的同系物中分子量最小的烃的电子式为CH2=CH2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
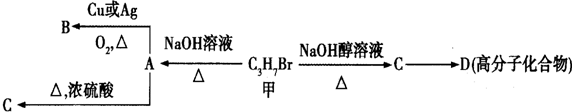
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com