
ЁОЬтФПЁПгаЛњЛЏКЯЮяЗДгІШчЯТЭМЃЌОнДЫЛиД№ЯТСаЮЪЬтЃК

ЃЈ1ЃЉввЯЉЕФНсЙЙЪНЮЊЃК__________ЁЃ
ЃЈ2ЃЉаДГіЗДгІЂкЂлЂмЕФЛЏбЇЗНГЬЪНЃК
Ђк_________________________ЃЌЗДгІРраЭЃК___________ЃЛ
Ђл_________________________ЃЌЗДгІРраЭЃК___________ЃЛ
Ђм_________________________ЃЌЗДгІРраЭЃК___________ЁЃ
ЃЈ3ЃЉЪЕбщЪвГЃгУЯТСазАжУжЦШЁввЫсввѕЅЃЌЧыЛиД№ЯрЙиЮЪЬтЃК

ЂйХЈСђЫсЕФзїгУЪЧ_______________ЁЃ
ЂкБЅКЭЬМЫсФЦШмвКЕФжївЊзїгУЪЧ___________________ЁЃ
ЂлШєвЊАбжЦЕУЕФввЫсввѕЅЗжРыГіРДЃЌгІВЩгУЕФВйзїЪЧ_________ЁЃ
ЂмНјааИУЪЕбщЪБЃЌзюКУЯђЪдЙмМзжаМгШыМИПщЫщДЩЦЌЃЌЦфФПЕФЪЧ_____________ЁЃ
ЁОД№АИЁП![]() 2CH3CH2OH+O2
2CH3CH2OH+O2![]() 2CH3CHO+2H2O бѕЛЏЗДгІ
2CH3CHO+2H2O бѕЛЏЗДгІ ![]() МгОлЗДгІ CH3COOH+CH3CH2OH
МгОлЗДгІ CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O ѕЅЛЏЗДгІЃЈЛђШЁДњЗДгІЃЉ ДпЛЏМСЁЂЮќЫЎМС ѕЅдкЦфжаЕФШмНтЖШаЁЃЌгаРћгкѕЅЗжРыЁЂГ§ШЅДжВњЦЗжаЕФввЫсКЭввДМ ЗжвК ЗРБЉЗаЃЈЗРжЙОчСвЗаЬкЃЉ
CH3COOCH2CH3+H2O ѕЅЛЏЗДгІЃЈЛђШЁДњЗДгІЃЉ ДпЛЏМСЁЂЮќЫЎМС ѕЅдкЦфжаЕФШмНтЖШаЁЃЌгаРћгкѕЅЗжРыЁЂГ§ШЅДжВњЦЗжаЕФввЫсКЭввДМ ЗжвК ЗРБЉЗаЃЈЗРжЙОчСвЗаЬкЃЉ
ЁОНтЮіЁП
ИљОнЬтИјзЊЛЏЙиЯЕжЊЃЌввЯЉКЭЫЎЗЂЩњМгГЩЗДгІЩњГЩввДМЃЌввДМдкЭзїДпЛЏМСЁЂМгШШЬѕМўЯТБЛбѕЦјбѕЛЏЩњГЩЕФCЮЊввШЉЃЛввДМКЭDЗЂЩњѕЅЛЏЗДгІЩњГЩввЫсввѕЅЃЌдђDЪЧввЫсЃЌввЯЉЗЂЩњМгОлЗДгІЩњГЩОлввЯЉЁЃ
ЃЈ1ЃЉввЯЉЕФНсЙЙЪНЮЊЃК![]() ЃЛ
ЃЛ
ЃЈ2ЃЉЗДгІЂкЂлЂмЕФЛЏбЇЗНГЬЪНКЭЗДгІРраЭЗжБ№ЮЊЃК2CH3CH2OH+O2![]() 2CH3CHO+2H2O бѕЛЏЗДгІЃЛ
2CH3CHO+2H2O бѕЛЏЗДгІЃЛ![]() МгОлЗДгІЃЛCH3COOH+CH3CH2OH
МгОлЗДгІЃЛCH3COOH+CH3CH2OH CH3COOCH2CH3+H2O ѕЅЛЏЗДгІЃЈЛђШЁДњЗДгІЃЉЃЛ
CH3COOCH2CH3+H2O ѕЅЛЏЗДгІЃЈЛђШЁДњЗДгІЃЉЃЛ
ЃЈ3ЃЉЂйжЦБИввЫсввѕЅЪБХЈСђЫсЕФзїгУЪЧЃКДпЛЏМСЃЌМгПьѕЅЛЏЗДгІЕФЫйТЪЃЛЮќЫЎМСЃЌгаРћгкѕЅЛЏЗДгІЕФе§ЯђНјааЃЛ
ЂкБЅКЭЬМЫсФЦШмвКЕФжївЊзїгУЪЧЃКНЕЕЭввЫсввѕЅЕФШмНтЖШЃЌгаРћгкѕЅЕФЗжРыЃЛГ§ШЅввЫсввѕЅжаЛьгаЕФввЫсКЭввДМЃЛ
ЂлгЩгкввЫсввѕЅФбШмгкБЅКЭЬМЫсФЦШмвКЃЌЙЪЪЕбщНсЪјввЪдЙмжаГіЯжЗжВуЯжЯѓЃЌНЋввЫсввѕЅЗжРыГіРДЃЌгІВЩгУЗжвКЗЈЁЃ
ЂмНјааЪЕбщЪБЃЌЯђЪдЙмМзжаМгШыМИПщЫщДЩЦЌЃЌЦфФПЕФЪЧЃКЗРжЙвКЬхМгШШЪБЕФОчСвЬјЖЏЃЌМДЗРжЙБЉЗаЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЁЖЛЏбЇгыЩњЛюЁЗКЯРэЩХЪГЃЌБЃГжгЊбјОљКтЃЌЪЧЧрЩйФъбЇЩњНЁПЕГЩГЄЕФживЊБЃжЄЁЃ
(1)ЕААзжЪЪЧШЫЬхБиашЕФгЊбјЮяжЪЃЌЫќдкШЫЬхФкзюжеЗжНтЮЊ_______
AЃЎЦЯЬбЬЧ BЃЎАБЛљЫс CЃЎжЌЗОЫс
(2)ЯжгаЯТСаЮхжжЮяжЪЃК
AЃЎЪГбЮ BЃЎЪГДз CЃЎЦЛЙћж DЃЎЦЯЬбЬЧ EЃЎЧрУЙЫи
ЧыАДЯТСавЊЧѓЬюПе(ЬюађКХ)ЁЃ
ИЛКЌЮЌЩњЫиCЕФЪЧ________ЃЛПЩжБНгНјШыбЊвКЃЌВЙГфФмСПЕФЪЧ_______ ЃЛгІгУзюЙуЗКЕФПЙЩњЫижЎвЛЕФЪЧ_______ЃЛМДПЩзїЮЊЕїЮЖМСЃЌгжПЩзїЮЊЗРИЏМСЕФЪЧ_______ЃЛЪГгУЙ§ЖрЛсв§Ц№бЊбЙЩ§ИпЁЂЩідрЪмЫ№ЕФ_________ЁЃ
(3)МІЕАКЌгаЗсИЛЕФЕААзжЪЃЌЫќдкШЫЬхФкЯћЛЏЙ§ГЬШчЯТЃК
![]()
ЧыЛиД№ЯТСаЮЪЬтЃК
aЃЎЯђМІЕАЧхШмвКжаЕЮШыМИЕЮХЈЯѕЫсЃЌЮЂШШЃЌМІЕАЧхБфЮЊ________ЩЋЁЃ
bЃЎАБЛљЫсОпгаСНадЃЌЪЧвђЮЊАБЛљЫсЗжзгжаМШКЌгаМюадЙйФмЭХгжКЌгаЫсадЙйФмЭХЃЌЦфжаЃЌМюадЙйФмЭХЪЧ____________ЃЌЫсадЙйФмЭХЪЧ____________ЁЃ
cЃЎЯђМІЕАЧхШмвКжаМгШыБЅКЭNa2SO4ШмвКЃЌгаАзЩЋГСЕэВњЩњЃЌЗЂЩњЕФЪЧ_______(ЬюЁАбЮЮіЁБЛђЁАБфадЁБ)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП(1)вбжЊKsp(AgCl)ЃН1.8ЁС10Ѓ10ЃЌдђНЋAgClЗХдкеєСѓЫЎжааЮГЩБЅКЭШмвКЃЌШмвКжаЕФc(AgЃЋ)ЪЧ________ЃП
(2)вбжЊKsp[Mg(OH)2]ЃН1.8ЁС10Ѓ11ЃЌдђНЋMg(OH)2ЗХШыеєСѓЫЎжааЮГЩБЅКЭШмвКЃЌШмвКЕФpHЮЊ________ЃП
(3)дк0.01 molЁЄLЃ1ЕФMgCl2ШмвКжаЃЌж№ЕЮМгШыNaOHШмвКЃЌИеКУГіЯжГСЕэЪБЃЌШмвКЕФpHЪЧ________ЃПЕБMg2ЃЋЭъШЋГСЕэЪБЃЌШмвКЕФpHЮЊ________ЃП
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП4жжЯрСкЕФжїзхЖЬжмЦкдЊЫиЕФЯрЖдЮЛжУШчБэЃЌдЊЫиxЕФдзгКЫЭтЕчзгЪ§ЪЧmЕФ2БЖЃЌyЕФбѕЛЏЮяОпгаСНадЁЃЛиД№ЯТСаЮЪЬтЃК
m | n | ||
x | y |
ЃЈ1ЃЉдЊЫиxдкжмЦкБэжаЕФЮЛжУЪЧЕк____ЁЃЦфЕЅжЪПЩВЩгУЕчНтШлШкЕФ___ЗНЗЈжЦБИЁЃгУЕчзгЪНБэЪОИУЛЏКЯЮяЕФаЮГЩЙ§ГЬЃК___ЁЃ
ЃЈ2ЃЉmЁЂnЁЂyШ§жждЊЫизюИпМлбѕЛЏЮяЕФЫЎЛЏЮяжаЃЌЫсадзюЧПЕФЪЧ____ЃЌМюадзюЧПЕФЪЧ____ЁЃ(ЬюЛЏбЇЪН)
ЃЈ3ЃЉЦјЬхЗжзг(mn)2ГЦЮЊФтТБЫиЃЌаджЪгыТБЫиРрЫЦЃЌЦфгыЧтбѕЛЏФЦШмвКЗДгІЕФЛЏбЇЗНГЬЪНЪЧ____ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПбЧТШЫсФЦЃЈNaClO2ЃЉдкШмвКжаПЩЩњГЩClO2ЁЂHClO2ЁЂClO2ЃЁЂClЃЕШЃЌЦфжаHClO2КЭClO2ЖМОпгаЦЏАззїгУЃЌЕЋClO2ЪЧгаЖОЦјЬхЁЃФГЮТЖШЯТЃЌВПЗжКЌТШзщЗжКЌСПЫцpHБфЛЏЧщПіШчЭМЫљЪОЃЌЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
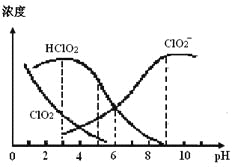
A. ЪЙгУИУЦЏАзМСЕФЪЪвЫpHдМЮЊ5.0
B. ИУЮТЖШЯТNaClO2ШмвКжаЃКc(NaЃЋ)ЃОc(ClO2Ѓ)ЃОc(OHЃ)ЃОc(HЃЋ)
C. ИУЮТЖШЯТHClO2ЕФЕчРыЦНКтГЃЪ§ЕФЪ§жЕKaЁж1.0ЁС10Ѓ6
D. ВЛЭЌpHЕФNaClO2ШмвКжаДцдкЯТСаЙиЯЕЃКc(NaЃЋ)= c(ClO2Ѓ)+ c(HClO2)+ c(ClO2)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШѕЕчНтжЪЕФЕчРыЦНКтЁЂбЮРрЕФЫЎНтЦНКтКЭФбШмЮяЕФШмвКЦНКтОљЪєгкЛЏбЇЦНКтЁЃ
ЃЈ1ЃЉвбжЊH2AдкЫЎжаДцдквдЯТЦНКтЃКH2A=H++HA-ЃЌHA-H++A2-ЁЃ
ЂйNaHAШмвКЕФpH___(ЬюДѓгкЁЂаЁгкЛђЕШгк)Na2AШмвКЕФpHЁЃ
ЂкФГЮТЖШЯТЃЌШєЯђ0.1mol/LЕФNaHAШмвКжаж№ЕЮЕЮМг0.1mol/LKOHШмвКжСШмвКГЪжаадЁЃДЫЪБИУЛьКЯШмвКжаЯТСаЙиЯЕжаЃЌвЛЖЈе§ШЗЕФЪЧ__ЁЃ
A.c(H+)c(OH-)=1ЁС10-14 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05mol/L
ЂлвбжЊГЃЮТЯТH2AЕФИЦбЮ(CaA)ЕФБЅКЭШмвКжаДцдквдЯТЦНКтЃКCaA(s)Ca2+(aq)+A2-(aq)ІЄH>0ЁЃШєвЊЪЙИУШмвКжаCa2+ХЈЖШБфаЁЃЌПЩВЩШЁЕФДыЪЉга___ЁЃ
A.Щ§ИпЮТЖШ B.НЕЕЭЮТЖШ C.МгШыNH4ClОЇЬх D.МгШыNa2AЙЬЬх
ЃЈ2ЃЉГЃЮТЯТЃЌШєдк0.10molL-1СђЫсЭШмвКжаМгШыЧтбѕЛЏФЦЯЁШмвКГфЗжНСАшЃЌгаЧГРЖЩЋЧтбѕЛЏЭГСЕэЩњГЩЃЌЕБШмвКЕФpH=8ЪБЃЌc(Cu2+)=___molL-1(Ksp[Cu(OH)2]=2.2ЁС10-20)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙигк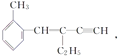 ЃЌЯТСаНсТле§ШЗЕФЪЧ( )
ЃЌЯТСаНсТле§ШЗЕФЪЧ( )
A. ИУгаЛњЮяЗжзгЪНЮЊC13H16 B. ИУгаЛњЮяЪєгкБНЕФЭЌЯЕЮя
C. ИУгаЛњЮяЗжзгжСЩйга4ИіЬМдзгЙВжБЯп D. ИУгаЛњЮяЗжзгзюЖрга13ИіЬМдзгЙВЦНУц
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаа№Ъіе§ШЗЕФЪЧ
A.pHЯрЕШЕФCH3COONaЁЂNaOHКЭNa2CO3Ш§жжШмвКХЈЖШДѓаЁЙиЯЕЮЊЃКc(NaOH)<c(CH3COONa)<c(Na2CO3)
B.0.1 mol/LЕФNaHAШмвКЃЌЦфpHЃН4ЃКc(HAЃ)>c(HЃЋ)>c(H2A)>c(A2Ѓ)
C.СНжжДзЫсШмвКЕФЮяжЪЕФСПХЈЖШЗжБ№ЮЊc1КЭc2ЃЌpHЗжБ№ЮЊaКЭaЃЋ1ЃЌдђc1ЃН10c2
D.pHЃН11ЕФNaOHШмвКгыpHЃН3ЕФДзЫсШмвКЕШЬхЛ§ЛьКЯЃЌЕЮШыЪЏШяШмвКГЪКьЩЋ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвдИѕЬњПѓ(КЌFeOЁЄCr2O3ЁЂAl2O3ЁЂSiO2ЕШ)ЮЊдСЯжЦБИЖўВнЫсИѕМиЕФЪЕбщВНжшШчЯТ:
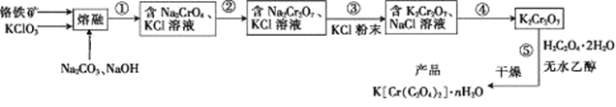
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉШєЁАШлШкЁБдклсліжаНјааЃЌЦфВФжЪПЩвдЪЧ____(ЬюЁАЬњЁБЁЂЁАЬеДЩЁБЛђЁАSiO2ЁБ)ЁЃ
ЃЈ2ЃЉ FeOЁЄCr2O3гыKClO3МАNa2CO3ЗЂЩњЗДгІЃЌЩњГЩFe2O3ЁЂKClЁЂNa2CrO4КЭCO2ЕФЛЏбЇЗНГЬЪНЮЊ____________________________ЁЃ
ЃЈ3ЃЉШлШкКѓЕФЙЬЬхжаКЌNa2CrO4ЁЂFe2O3ЁЂNa2SiO3ЁЂNaAlO2ЁЂKClЕШ, ВНжшЂйАќКЌСНДЮЙ§ТЫВйзїЃКвЛЪЧЫЎНўКѓЙ§ТЫЃЛЖўЪЧЕїНкЫљЕУТЫвКpHЮЊ7~8ЃЌМгШШжѓЗаАыаЁЪБЃЌГУШШЙ§ТЫЁЃЕквЛДЮЙ§ТЫТЫдќжаЕФжївЊГЩЗжЮЊ______ЃЌЕкЖўДЮЙ§ТЫТЫдќЕФжївЊГЩЗжЮЊ_________ЁЃ
ЃЈ4ЃЉВНжшЂкашМгШыЫсЃЌдђМгШыЯЁСђЫсЪБЗЂЩњЗДгІЕФРызгЗНГЬЪНЮЊ___________ЁЃ
ЃЈ5ЃЉВНжшЂмАќКЌЕФОпЬхВйзїга_____ЁЂ_____ЃЌЙ§ТЫЁЂЯДЕгЃЌдйОИЩдяЕУЕНK2Cr2O7ОЇЬхЁЃ(гаЙиЮяжЪЕФШмНтЖШЧњЯпШчЭМЫљЪО)
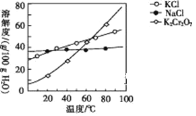
ЃЈ6ЃЉвбжЊK[Cr(C2O4)2]ЕФЯрЖдЗжзгжЪСПЮЊ267ЁЃВЩгУШШжиЗжЮіЗЈВтЖЈK[Cr(C2O4)2]ЁЄnH2OбљЦЗЫљКЌНсОЇЫЎЪ§ФПЃЌНЋбљЦЗМгШШЕН80 ЁцЪБЃЌЪЇЕєШЋВПНсОЇЫЎЃЌЪЇжи16.8%ЁЃK[Cr(C2O4)2]ЁЄnH2OОЇЬхжаn=____ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com