
现有阳离子交换膜、阴离子交换膜、石墨电极,请用氯碱工业中的膜技术原理,回答下列问题。
(1)写出氯碱工业中电解饱和食盐水的离子方程式 ;
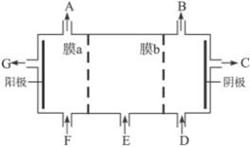
(2)请利用交换膜技术,根据上图框架,设计一个电解硫酸钠溶液制氢氧化钠溶液和硫酸溶液的装置,标出进出物质的化学式:
A_________;C_________; E_________;膜b为 离子交换膜(填“阳”或“阴”)。
【知识点】电解原理的应用
【答案解析】(1)2Cl-+2H2O 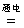 2OH-+Cl2↑+H2↑;
2OH-+Cl2↑+H2↑;
(2) O2;NaOH;Na2SO4(溶液);阳
解析:(1)氯碱工业中电解饱和食盐水的离子方程式:2Cl-+2H2O 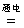 2OH-+Cl2↑+H2↑;(2)阳离子交换膜只能让阳离子通过,类推阴离子交换膜也应该只能让阴离子通过。氯碱工业中H2O参与放电而产生NaOH,电解Na2SO4溶液时阴极区H+放电(阴极:2H++2e-====H2↑)破坏水的电离平衡而使溶液呈碱性,所以C出来的物质为NaOH;阳极区OH-放电(4OH-+4e-====2H2O+O2↑)破坏水的电离平衡而使溶液呈酸性A处出来的物质为 O2。③氯碱工业中为了得到纯净的NaOH产品,阴极区加入水(含少量NaOH增强导电性)。类推:电解Na2SO4溶液要得到“纯净”的产品,在阴极区、阳极区也只能加入水,在电解池的中央部分加入Na2SO4溶液,即E处加Na2SO4溶液。根据分析膜b只能让阳离子通过,为阳离子交换膜。
2OH-+Cl2↑+H2↑;(2)阳离子交换膜只能让阳离子通过,类推阴离子交换膜也应该只能让阴离子通过。氯碱工业中H2O参与放电而产生NaOH,电解Na2SO4溶液时阴极区H+放电(阴极:2H++2e-====H2↑)破坏水的电离平衡而使溶液呈碱性,所以C出来的物质为NaOH;阳极区OH-放电(4OH-+4e-====2H2O+O2↑)破坏水的电离平衡而使溶液呈酸性A处出来的物质为 O2。③氯碱工业中为了得到纯净的NaOH产品,阴极区加入水(含少量NaOH增强导电性)。类推:电解Na2SO4溶液要得到“纯净”的产品,在阴极区、阳极区也只能加入水,在电解池的中央部分加入Na2SO4溶液,即E处加Na2SO4溶液。根据分析膜b只能让阳离子通过,为阳离子交换膜。
【思路点拨】本题考查电解原理的应用,注意使用类比的方法解决问题。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
Fe和Al是两种常见的金属,将它们按一定的质量比组成混合物。
(1)取一定质量的该混合物,向其中加入足量的NaOH溶液。生成气体的体积在标准状况下为a L,则反应的离子方程式为________________;混合物中的Al的物质的量为________(用含字母的表达式表示)。
(2)另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积在标准状况下b L,则反应中转移电子的物质的量为________;混合物中Fe的质量为________(用含字母的表达式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在25ºC时,将两根铂电极插入一定量的硫酸钠饱和溶液中进行电解,当电路中有a mol电子转移时,溶液中析出mg Na2SO4 ·10 H2 O晶体。若温度不变,在剩余溶液中溶质的质量分数为
A.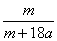 ×100% B.
×100% B.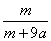 ×100%
×100%
C.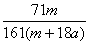 ×100% D.
×100% D.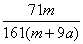 ×100%
×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
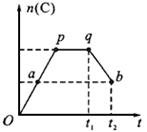
下图为某化学反应速率-时间图。在t1时刻升高温度或增大压强,都符合下图所示变化的反应是
A.2SO2(g)+O2(g) 2SO3(g) △H<0
2SO3(g) △H<0
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H<0
4NO(g)+6H2O(g) △H<0
C.H2(g)+I2(g) 2HI(g) △H>0
2HI(g) △H>0
D.C(s)+H2O(g) CO(g)+H2(g) △H>0
CO(g)+H2(g) △H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
下图为装有活塞(质量忽略不计)的密闭容器,内盛22.4mL一氧化氮,若通入11.2mL氧气(气体体积均在标准状况下测定),保持温度压强不变,则容器内的密度为(提示:不考虑NO转化为NO2的可逆性)
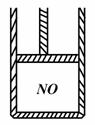 A. 等于1.369 g·L-1
A. 等于1.369 g·L-1
B. 等于2.054 g·L-1
C. 在1.369g·L-1和2.054g·L-1之间
D. 在2.054g·L-1和4.108g·L-1之间
查看答案和解析>>
科目:高中化学 来源: 题型:
向Ba(OH)2溶液中逐滴滴入稀H2SO4,则溶液的导电能力,下列叙述,描述正确的是
A.开始时,导电能力肯定最强 B.当沉淀为最大值时,导电性最弱
C.先变强,后变弱 D.逐渐变弱
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(KFeO4)是一种新型、高效、多功能水处理剂。下列反应可制取KFeO4:2Fe(OH)3+3Cl2+10KOH 2KFeO4+6KCl+8H2O,对于该反应下列说法正确的是
2KFeO4+6KCl+8H2O,对于该反应下列说法正确的是
A.该反应是置换反应 B.钾元素化合价降低
C.Fe(OH)3发生还原反应 D.Cl2是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
向2.0 L恒容密闭容器中充入1.0 mol PCl5,在温度为T℃时发生如下反应PCl5(g)  PCl3(g)+C12(g) ΔH=+124 kJ·mol-1。反应过程中测定的部分数据见下表:
PCl3(g)+C12(g) ΔH=+124 kJ·mol-1。反应过程中测定的部分数据见下表:
| 时间t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
回答下列问题: [已知:Ksp(Ag3 PO4) =1.4 × 10-16,Ksp(AgCl) =1.8 × 10-10]
(1)反应在前50 s的平均速率v(PCl5) = ▲ 。
(2)温度为T℃时,该反应的化学平衡常数= ▲ 。
(3)要提高上述反应的转化率,可采取的措施是 ▲ (任写一种)。
(4)在温度为T℃时,若起始时充入0.5 mol PCl5和a mol Cl2,平衡时PCl5的转化率仍为20%,则a= ▲ 。
(5)PCl5在热水中完全水解生成H3 PO4,该反应的化学方程式是 ▲ 。 若将0.01 mol PCl5投入l L热水中,再逐滴加入0.1 mol /L AgNO3溶液,先产生的沉淀是 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com