
ΓΨΧβΡΩΓΩ»ΦΟΚ―ΧΤχ÷–Κ§”–“ΜΕ®ΝΩΒΡΕΰ―θΜ·ΝρΘ§Μα‘λ≥…¥σΤχΈέ»ΨΓΘ“ΜΕ®ΧθΦΰœ¬Θ§Ά®Ιΐœ¬Ν–Ζ¥”ΠΩ…“‘ Βœ÷»ΦΟΚ―ΧΤχ÷–ΝρΒΡΜΊ ’ΘΚ2COΘ®gΘ©+SO2Θ®gΘ©![]() 2CO2Θ®gΘ©+SΘ®lΘ© HΘ§ «κΜΊ¥πΘΚ
2CO2Θ®gΘ©+SΘ®lΘ© HΘ§ «κΜΊ¥πΘΚ
Δ≈“―÷ΣCOΘ®gΘ©+![]() O2Θ®gΘ©=CO2Θ®gΘ© ΓςH1=-a kJΓΛmol-1
O2Θ®gΘ©=CO2Θ®gΘ© ΓςH1=-a kJΓΛmol-1
SΘ®sΘ©+O2Θ®gΘ©=SO2Θ®gΘ© H2=-b kJΓΛmol-1
SΘ®lΘ©=SΘ®sΘ© H3=-c kJΓΛmol-1
‘ρΓςH=_______kJΓΛmol-1ΓΘ
ΔΤ“ΜΕ®Έ¬Ε»œ¬Θ§œρ2LΚψ»ίΟή±’»ίΤς÷–Ά®»κ2molCOΚΆ1molSO2Θ§‘Ύ≤ΜΆ§ΧθΦΰœ¬Ϋχ––Ζ¥”ΠΘΚ2COΘ®gΘ©+SO2Θ®gΘ©![]() 2CO2Θ®gΘ©+SΘ®lΘ©Θ§Ζ¥”ΠΧεœΒΉή―Ι«ΩΥφ ±ΦδΒΡ±δΜ·»γΆΦΥυ ΨΘΚ
2CO2Θ®gΘ©+SΘ®lΘ©Θ§Ζ¥”ΠΧεœΒΉή―Ι«ΩΥφ ±ΦδΒΡ±δΜ·»γΆΦΥυ ΨΘΚ
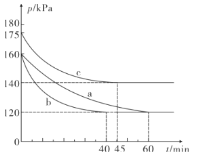
ΔΌΆΦ÷–»ΐΉι Β―ι¥”Ζ¥”ΠΩΣ Φ÷Ν¥οΒΫΤΫΚβ ±ΒΡΖ¥”ΠΥΌ¬ vΘ®COΘ©”…¥σΒΫ–ΓΒΡ¥Έ–ρΈΣ___Θ® Χν Β―ι–ρΚ≈Θ©ΘΜ ”κaΉιœύ±»Θ§cΉιΗΡ±δΒΡ Β―ιΧθΦΰΩ…Ρή «___ΓΘ
ΔΎ»τbΉιΖ¥”ΠΫχ––ΒΫ40min ±¥οΒΫΤΫΚβΉ¥Χ§Θ§¥Υ ±≤βΒΟ»ίΤς÷–ΤχΧεΒΡΟήΕ»±»Ζ¥”Π«ΑΦθ…ΌΝΥ12.8 gΓΛL-1Θ§‘ρCOΒΡΈο÷ ΒΡΝΩ≈®Ε»cΘ®COΘ©=___Θ§Ζ¥”Π‘Ύ¥ΥΧθΦΰœ¬ΒΡΜ·―ßΤΫΚβ≥Θ ΐK=___
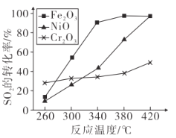
Δ«ΤδΥϊΧθΦΰœύΆ§ΓΔ¥ΏΜ·ΦΝ≤ΜΆ§ ±Θ§SOΘ§ΒΡΉΣΜ·¬ ΥφΖ¥”ΠΈ¬Ε»ΒΡ±δΜ·»γœ¬ΆΦΘ§260ΓψC ±Θ§______Θ®ΧνFe2O3ΓΔNiOΜρCr2O3Θ©Ής¥ΏΜ·ΦΝΖ¥”ΠΥΌ¬ ΉνΩλΘΜFe2O3ΚΆNiOΉς¥ΏΜ·ΦΝΨυ ΙSO2ΒΡΉΣΜ·¬ ¥οΒΫΉνΗΏΘ§≤ΜΩΦ¬«ΦέΗώ“ρΥΊΘ§―Γ‘ώFe2O3ΒΡ÷ς“Σ”≈Βψ «_______ΓΘ
Δ»SO2ΓΣO2÷ Ή”ΫΜΜΜΡΛ»ΦΝœΒγ≥Ί Βœ÷ΝΥ÷ΤΝρΥαΓΔΖΔΒγΓΔΜΖ±Θ»ΐœνΡΩ±ξΘ§¥ΥΒγ≥ΊΒΡΗΚΦΪΖ¥”Π ΫΈΣ____________ΓΘ
ΓΨ¥πΑΗΓΩb+c-2a b>c>a …ΐΗΏΈ¬Ε» 0.2molΓΛL-1 160 Cr2O3 ‘ΎœύΕ‘ΫœΒΆΒΡΈ¬Ε»œ¬Ω…ΜώΒΟΫœΗΏΒΡSO2ΒΡΉΣΜ·¬ Θ§¥”ΕχΫΎ‘Φ¥σΝΩΡή‘¥ SO2+2H2O-2e-=SO42-+4H+
ΓΨΫβΈωΓΩ
ΗυΨίΗ«ΥΙΕ®¬…Ω…÷ΣΘ§ΓςHΩ…“‘Ά®ΙΐΓςH1ΓΝ=2-H2-H3ΒΟΒΫΘΜ2COΘ®gΘ©+SO2Θ®gΘ©![]() 2CO2Θ®gΘ©+SΘ®lΘ©ΈΣΖ¥”Π«ΑΚσΤχΧεΖ÷Ή” ΐΦθ–ΓΒΡΖ¥”ΠΘ§”…ΧβΘ®2Θ©ΆΦ÷–«ζœΏΙ’ΒψΩ…÷ΣΘ§bΉιœ»¥οΒΫΤΫΚβΘ§ΉνΚσΈΣaΉιΘΜSO2ΓΣO2÷ Ή”ΫΜΜΜΡΛ»ΦΝœΒγ≥Ί÷–SO2Ά®»κΗΚΦΪΘ§O2Ά®»κ’ΐΦΪΓΘ
2CO2Θ®gΘ©+SΘ®lΘ©ΈΣΖ¥”Π«ΑΚσΤχΧεΖ÷Ή” ΐΦθ–ΓΒΡΖ¥”ΠΘ§”…ΧβΘ®2Θ©ΆΦ÷–«ζœΏΙ’ΒψΩ…÷ΣΘ§bΉιœ»¥οΒΫΤΫΚβΘ§ΉνΚσΈΣaΉιΘΜSO2ΓΣO2÷ Ή”ΫΜΜΜΡΛ»ΦΝœΒγ≥Ί÷–SO2Ά®»κΗΚΦΪΘ§O2Ά®»κ’ΐΦΪΓΘ
Θ®1Θ©ΫΪCOΘ®gΘ©+![]() O2Θ®gΘ©=CO2Θ®gΘ©±ξΦ«ΈΣΔΌΘ§SΘ®sΘ©+O2Θ®gΘ©=SO2Θ®gΘ©±ξΦ«ΈΣΔΎΘ§SΘ®lΘ©=SΘ®sΘ©±ξΦ«ΈΣΔέΘ§Ζ¥”Π2COΘ®gΘ©+SO2Θ®gΘ©
O2Θ®gΘ©=CO2Θ®gΘ©±ξΦ«ΈΣΔΌΘ§SΘ®sΘ©+O2Θ®gΘ©=SO2Θ®gΘ©±ξΦ«ΈΣΔΎΘ§SΘ®lΘ©=SΘ®sΘ©±ξΦ«ΈΣΔέΘ§Ζ¥”Π2COΘ®gΘ©+SO2Θ®gΘ©![]() 2CO2Θ®gΘ©+SΘ®lΘ©Ω…”…ΔΌΓΝ2-ΔΎ-ΔέΒΟΒΫΘ§ΗυΨίΗ«ΥΙΕ®¬…Θ§ΓςH=2ΓΝΓςH1-H2-H3==Θ®-2a +b+cΘ©kJΓΛmol-1ΓΘ
2CO2Θ®gΘ©+SΘ®lΘ©Ω…”…ΔΌΓΝ2-ΔΎ-ΔέΒΟΒΫΘ§ΗυΨίΗ«ΥΙΕ®¬…Θ§ΓςH=2ΓΝΓςH1-H2-H3==Θ®-2a +b+cΘ©kJΓΛmol-1ΓΘ
Θ®2Θ©ΔΌ”…ΧβΘ®2Θ©ΆΦ÷–«ζœΏΙ’ΒψΩ…÷ΣΘ§bΉιœ»¥οΒΫΤΫΚβΘ§ΉνΚσΈΣaΉιΘ§Ι Ζ¥”ΠΥΌ¬ vΘ®COΘ©”…¥σΒΫ–ΓΒΡ¥Έ–ρΈΣb>c>aΓΘ
ΔΎΖ¥”Π¥οΒΫΤΫΚβΉ¥Χ§Θ§¥Υ ±≤βΒΟ»ίΤς÷–ΤχΧεΒΡΟήΕ»±»Ζ¥”Π«ΑΦθ…ΌΝΥ12.8 gΓΛL-1Θ§Φθ…ΌΒΡΤχΧε÷ ΝΩΦ¥ΈΣSΘ®lΘ©ΒΡ÷ ΝΩΘ§m=12.8 gΓΛL-1ΓΝ2L=25.6gΘ§n=![]() Θ§ΗυΨίΖ¥”ΠΖΫ≥Χ ΫΩ…÷ΣΘ§≤Έ”κΖ¥”ΠΒΡ“Μ―θΜ·ΧΦΒΡΈο÷ ΒΡΝΩΈΣn(CO)=1.6molΘ§ Θ”ύΒΡ“Μ―θΜ·ΧΦΒΡΈο÷ ΒΡΝΩΈΣ0.4molΘ§‘ρCOΒΡΈο÷ ΒΡΝΩ≈®Ε»cΘ®COΘ©=0.2molΓΛL-1Θ§c(CO2)=0.8 molΓΛL-1Θ§n(SO2)=0.1 molΓΛL-1Θ§Μ·―ßΤΫΚβ≥Θ ΐK=
Θ§ΗυΨίΖ¥”ΠΖΫ≥Χ ΫΩ…÷ΣΘ§≤Έ”κΖ¥”ΠΒΡ“Μ―θΜ·ΧΦΒΡΈο÷ ΒΡΝΩΈΣn(CO)=1.6molΘ§ Θ”ύΒΡ“Μ―θΜ·ΧΦΒΡΈο÷ ΒΡΝΩΈΣ0.4molΘ§‘ρCOΒΡΈο÷ ΒΡΝΩ≈®Ε»cΘ®COΘ©=0.2molΓΛL-1Θ§c(CO2)=0.8 molΓΛL-1Θ§n(SO2)=0.1 molΓΛL-1Θ§Μ·―ßΤΫΚβ≥Θ ΐK=![]() ΓΘ
ΓΘ
Θ®3Θ©260ΓψC ±Θ§œύΆ§ ±ΦδΡΎΦ”»κCr2O3ΚσSO2ΉΣΜ·¬ ΉνΗΏΘ§“ρΈΣΈ¬Ε»œύΆ§Θ§¥ΏΜ·ΦΝ≤Μ”ΑœλΤΫΚβΘ§Υυ“‘Φ”»κCr2O3ΉνΩλ¥οΒΫΤΫΚβΘΜ¥”’έœΏΆΦ÷–Ω…÷ΣFe2O3Ής¥ΏΜ·ΦΝ ±Θ§‘ΎœύΕ‘ΫœΒΆΈ¬Ε»Ω…ΜώΒΟΫœΗΏΒΡSO2ΒΡΉΣΜ·¬ Θ§¥”ΕχΫΎ‘Φ¥σΝΩΡή‘¥ΓΘ
Θ®4Θ©SO2‘ΎΗΚΦΪ ßΒγΉ”Ζ¥”Π―θΜ·Ζ¥”Π…ζ≥…ΝρΥαΘ§ΒγΦΪΖ¥”Π ΫΈΣSO2+2H2O-2e-=SO42-+4H+ΓΘ



| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩHClO4ΓΔH2SO4ΓΔHNO3ΚΆHClΕΦ ««ΩΥαΘ§ΥϋΟ«ΒΡΥα–‘‘ΎΥ°»ή“Κ÷–≤ν±π≤Μ¥σΓΘ“‘œ¬ «Ρ≥Έ¬Ε»œ¬’βΥΡ÷÷Υα‘Ύ±υ¥ΉΥα÷–ΒΡΒγάκ≥Θ ΐΘΚ
Υα | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6ΓΝ10Θ≠5 | 6.3ΓΝ10Θ≠9 | 1.6ΓΝ10Θ≠9 | 4.2ΓΝ10Θ≠10 |
œ¬Ν–ΥΒΖ®÷–≤Μ’ΐ»ΖΒΡ «(ΓΓΓΓ)
A.‘Ύ±υ¥ΉΥα÷–’βΥΡ÷÷ΥαΕΦΟΜ”–Άξ»ΪΒγάκ
B.‘Ύ±υ¥ΉΥα÷–HClO4 «’βΥΡ÷÷Υα÷–Ήν«ΩΒΡΥα
C.‘Ύ±υ¥ΉΥα÷–H2SO4ΒΡΒγάκΖΫ≥Χ ΫΈΣH2SO4===2HΘΪΘΪSO![]()
D.Υ°≤ΜΡή«χΖ÷’βΥΡ÷÷ΥαΒΡ«Ω»θΘ§ΒΪ±υ¥ΉΥαΩ…“‘«χΖ÷’βΥΡ÷÷ΥαΒΡ«Ω»θ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΚΘ―σ «‘ΣΥΊΒΡ“ΓάΚΘ§ΚΘΥ°÷–Κ§”–¥σΝΩ¬±Ήε‘ΣΥΊΓΘNaClΨßΑϊΫαΙΙ Ψ“βΆΦ»γœ¬Υυ ΨΘ®ΨßΑϊ±Ώ≥ΛΈΣa nm).

(1)‘ΣΥΊ NaΒΡΦέΒγΉ”±ΜΦΛΖΔΒΫœύΝΎΗΏΡήΦΕΚσ–Έ≥…ΒΡΦΛΖΔΧ§Na‘≠Ή”Θ§ΤδΦέΒγΉ”ΙλΒά±μ Ψ ΫΈΣ__________ΓΘ
(2)≥ΐΝΥ NaClΘ§Cl ‘ΣΥΊΜΙΡή–Έ≥…Εύ÷÷ΦέΧ§ΒΡΜ·ΚœΈοΘ§»γNaClOΓΔNaClO2ΓΔNaClO3ΓΔNaClO4Θ§’βΥΡ÷÷ΡΤ―ΈΕ‘”ΠΒΡΥαΒΡΥα–‘“ά¥Έ‘ω«ΩΘ§ ‘Ϋβ ΆHClO4ΒΡΥα–‘«Ω”ΎHClO3ΒΡ‘≠“ρΘΚ__________ΓΘ
(3)‘Ύ Β±ΧθΦΰœ¬Θ§ΒγΫβNaClΥ°»ή“ΚΩ…÷ΤΒΟ NaClO3ΓΘ
ΔΌNaClΥ°»ή“Κ÷–¥φ‘ΎΒΡΈΔΝΘΦδΉς”ΟΝΠ”–________Θ®Χν–ρΚ≈Θ©ΓΘ
A.άκΉ”Φϋ B.ΦΪ–‘Φϋ C.≈δΈΜΦϋ D.«βΦϋ
ΔΎΗυΨίΦέ≤ψΒγΉ”Ε‘ΜΞ≥βάμ¬έΘ§‘Λ≤βClO3-ΒΡΩ’ΦδΙΙ–ΆΈΣ________Θ§–¥≥ω“ΜΗωClO3-ΒΡΒ»ΒγΉ”ΧεΒΡΜ·―ßΖϊΚ≈ΘΚ______________
(4)‘ΎNaClΨßΧε÷–Θ§Na ΈΜ”ΎCl ΥυΈß≥…ΒΡ’ΐ______ΟφΧεΒΡΧε–ΡΘ§ΗΟΕύΟφΧεΒΡ±Ώ≥Λ «______nmΓΘ
(5)Na ΑκΨΕ”κClΑκΨΕΒΡ±»÷ΒΈΣ______Θ®±ΘΝτ–Γ ΐΒψΚσ3ΈΜΘ§![]() =1.414)ΓΘ
=1.414)ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–ΗςΉι±δΜ·÷–Θ§«Α’Ώ–Γ”ΎΚσ’ΏΒΡ «(ΓΓΓΓ)
ΔΌCH4(g)ΘΪ2O2(g)===CO2(g)ΘΪ2H2O(l)ΓΓΠΛH1
CH4(g)ΘΪ2O2(g)===CO2(g)ΘΪ2H2O(g)ΓΓΠΛH2
ΔΎ2H2(g)ΘΪO2(g)®T2H2O(l)ΓΓΠΛH1
H2(g)ΘΪ![]() O2(g)===H2O(l)ΓΓΠΛH2
O2(g)===H2O(l)ΓΓΠΛH2
Δέt Γφ ±Θ§‘Ύ“ΜΕ®ΧθΦΰœ¬Θ§ΫΪ1 mol SO2ΚΆ1 mol O2Ζ÷±π÷Ο”ΎΚψ»ίΚΆΚψ―ΙΒΡΝΫΗωΟή±’»ίΤς÷–Θ§¥οΒΫΤΫΚβΉ¥Χ§ ±Ζ÷±πΖ¥”ΠΖ≈≥ωΒΡ»»ΝΩ
ΔήCaCO3(s)===CaO(s)ΘΪCO2(g)ΓΓΠΛH1
CaO(s)ΘΪH2O(l)===Ca(OH)2(s)ΓΓΠΛH2
A. ΔΌΔΎΔέ B. ΔΎΔή C. ΔΎΔέΔή D. ΔέΔή
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΫΪ10.7g ¬»Μ·οßΙΧΧε”κΉψΝΩ«β―θΜ·ΗΤΙΧΧεΜλΚœΦ”»»Θ§ Ι÷°≥δΖ÷Ζ¥”ΠΓΘ«κΦΤΥψΘΚ
Θ®1Θ©…ζ≥…ΒΡΑ±Τχ‘Ύ±ξΉΦΉ¥Ωωœ¬ΒΡΧεΜΐ «Εύ…Ό…ΐ____ΘΩ
Θ®2Θ©»τΫΪ’β–©Α±Τχ≈δ≥…500mLΑ±Υ°Θ§ΗΟΑ±Υ°ΒΡΈο÷ ΒΡΝΩ≈®Ε» «Εύ…Ό____________ΘΩ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩν― «“Μ÷÷“χΑΉ…ΪΒΡΙΐΕ…Ϋπ τΘ§”–ΝΦΚΟΒΡΩΙΗ· ¥–‘Θ§ ««ΩΕ»÷ΊΝΩ±»ΉνΗΏΒΡΫπ τΓΘ«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Δ≈ΜυΧ§ν―‘≠Ή”ΚΥΆβΙ≤”–_____ΗωΧν≥δΝΥΒγΉ”ΒΡ‘≠Ή”ΙλΒάΘ§ΤδΆβΈßΒγΉ”ΒΡΙλΒά±μ¥ο ΫΈΣ_____ΓΘ
ΔΤΫπ τν―”–ΝΫ÷÷Ά§ΥΊ“λ–ΈΧεΓΘ
ΔΌ‘ΎΫœΗΏΈ¬Ε» ±ΨΏ”–Χε–ΡΝΔΖΫΨßΑϊΘ§ΤδΩ’Φδάϊ”Ο¬ ΈΣ_______Θ®”ΟΚ§Π–ΒΡ ΫΉ”±μ ΨΘ©ΓΘ
ΔΎ‘ΎΫœΒΆΈ¬Ε» ±Θ§≤…”ΟΟφ–ΡΝΔΖΫΉνΟήΕ―ΜΐΘ§ΤδΨßΑϊ÷–”–»τΗ…Ηω’ΐΥΡΟφΧεΩ’œΕΘ®»γœ¬ΆΦ÷–aΓΔbΓΔcΓΔdΥΡΗων―‘≠Ή”–Έ≥…“ΜΗω’ΐΥΡΟφΧεΘ§ΤδΡΎ≤ΩΈΣ’ΐΥΡΟφΧεΩ’œΕΘ©Θ§Ω…“‘Χν≥δΤδΥϊ‘≠Ή”ΓΘ»τΨßΑϊ÷–Υυ”–ΒΡ’ΐΥΡΟφΧεΩ’œΕ÷–ΕΦΧν≥δ1Ηω«β‘≠Ή”Θ§‘ρ–Έ≥…ΒΡ«βΜ·ν―ΒΡΜ·―ß ΫΈΣ________ΓΘ
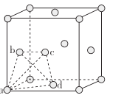
Δ«Ϋπ τν―ΒΡ»έΒψΓΔ”≤Ε»Ψυ±»¬Ν¥σΘ§Ω…ΡήΒΡ‘≠“ρ «_______ΓΘ
Δ»TiCl4 «¬»Μ·Ζ®÷Τ»Γν―ΒΡ÷–Φδ≤ζΈοΓΘTiCl4ΚΆSiCl4‘Ύ≥ΘΈ¬œ¬ΕΦ «“ΚΧεΘ§Ζ÷Ή”ΫαΙΙœύΆ§ΓΘ≤…”Ο’τΝσΒΡΖΫΖ®Ζ÷άκTiCl4ΚΆSiCl4ΒΡΜλΚœΈοΘ§œ»ΜώΒΟΒΡΝσΖ÷ «_______Θ®ΧνΜ·―ß ΫΘ©ΓΘ
Δ…”–ΜζΚœ≥…÷–Ρ≥÷÷Κ§ν―¥ΏΜ·ΦΝΒΡΫαΙΙ»γΆΦΥυ ΨΓΘ
ΔΌΉι≥…ΗΟ¥ΏΜ·ΦΝΒΡ‘ΣΥΊ÷–Θ§ΒγΗΚ–‘Ήν¥σΒΡ «____Θ®Χν‘ΣΥΊΟϊ≥ΤΘ©ΓΘ
ΔΎΗΟ¥ΏΜ·ΦΝ÷–ΧΦ‘≠Ή”ΒΡ‘”Μ·ΖΫ ΫΈΣ_____ΓΘ
Δ ≈δΚœΈοΘέTiClΘ®H2OΘ©5]Cl2ΒΡ≈δΈΜ ΐ «__Θ§ œρΚ§1 molΗΟ≈δΚœΈοΒΡΥ°»ή“Κ÷–Φ”»κΉψΝΩAgNO3»ή“ΚΘ§Ω……ζ≥…AgCl≥ΝΒμΒΡΈο÷ ΒΡΝΩΈΣ__ΓΘ
ΔΥκφΜ·ν―Θ®TiCNΘ©Ω…”Ο”Ύ÷Τ±ΗΩ’ΤχΨΜΜ·≤ΡΝœΘ§“―÷Σ«ηΤχΖ÷Ή”ΘέΘ®CNΘ©2]÷–Υυ”–‘≠Ή”Ψυ¬ζΉψΉνΆβ≤ψ8ΒγΉ”Έ»Ε®ΫαΙΙΘ§‘ρ«ηΤχΖ÷Ή”÷–Π“ΦϋΚΆΠ–ΦϋΒΡΗω ΐ±»ΈΣ____ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩN2Ζ÷Ή”‘Ύ¥ΏΜ·ΦΝΒΡΉς”Οœ¬ΖΔ…ζΒΡ“ΜœΒΝ–ΉΣΜ·»γΆΦΥυ ΨΓΘœ¬Ν––π ω’ΐ»ΖΒΡ «Θ® Θ©
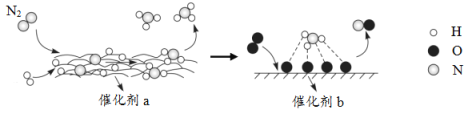
A.![]() ‘ΎΖ¥”ΠΙΐ≥Χ÷–Ής¥ΏΜ·ΦΝ
‘ΎΖ¥”ΠΙΐ≥Χ÷–Ής¥ΏΜ·ΦΝ
B.¥ΏΜ·ΦΝa±μΟφΖΔ…ζΝΥΖ÷ΫβΖ¥”ΠΚΆΜ·ΚœΖ¥”Π
C.¥ΏΜ·ΦΝaΓΔb‘ω¥σΝΥΗΟάζ≥Χ÷–ΒΡΉν¥σΡήάίΘ®ΜνΜ·ΡήΘ©
D.¥ΏΜ·ΦΝb±μΟφΖΔ…ζΒΡΖ¥”ΠΈΣΘΚ4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩFe(NO3)3 «“Μ÷÷÷Ί“ΣΒΡΟΫ»ΨΦΝΚΆΫπ τ±μΟφ¥ΠάμΦΝΘ§“Ή»ή”ΎΥ°ΓΔ““¥ΦΘ§ΈΔ»ή”ΎœθΥαΘ§ΨΏ”–Ϋœ«ΩΒΡ―θΜ·–‘ΓΘΡ≥―ßœΑ–ΓΉιάϊ”Ο»γΆΦΉΑ÷Ο÷Τ±ΗFe(NO3)3≤ΔΧΫΨΩΤδ–‘÷ ΓΘ
ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
≤Ϋ÷η“ΜΘΚ÷Τ±ΗFe(NO3)3
a÷–Φ”»κ100mL8molΓΛL-1œθΥαΘ§b÷–Φ”»κ5.6gΧζ–ΦΘ§ΫΪœθΥα”κΧζ–ΦΜλΚœΚσΥ°‘ΓΦ”»»ΓΘ
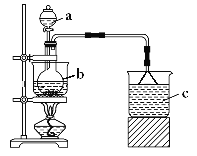
Θ®1Θ©“«ΤςbΒΡΟϊ≥Τ «___ΓΘ
Θ®2Θ©Ζ¥”ΠΙΐ≥Χ÷–Ιέ≤λΒΫb÷–Χζ–Φ»ήΫβΘ§»ή“Κ±δΜΤ…ΪΘ§“ΚΟφ…œΖΫ”–ΚλΉΊ…ΪΤχΧε≤ζ…ζΘ§“«Τςb÷–Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ «___ΓΘ
Θ®3Θ©c÷–Υυ Δ ‘ΦΝ «___Θ§ΒΙΩέ¬©ΕΖΒΡΉς”Ο «___ΓΘ
Θ®4Θ©»τ“Σ¥”Ζ¥”ΠΚσΒΡ»ή“Κ÷–ΒΟΒΫFe(NO3)3ΨßΧεΘ§”Π≤…»ΓΒΡ≤ΌΉς «ΘΚΫΪ»ή“Κ’τΖΔ≈®ΥθΓΔά以ΫαΨßΓΔΙΐ¬ΥΓΔ”Ο____œ¥Β”ΓΔΗ…‘οΓΘ
≤Ϋ÷ηΕΰΘΚΧΫΨΩFe(NO3)3ΒΡ–‘÷
i.≤βΒΟ0.1molΓΛL-1Fe(NO3)3»ή“ΚΒΡpH‘ΦΒ»”Ύ1.6ΓΘ
ii.ΫΪ5mL0.1molΓΛL-1Fe(NO3)3»ή“ΚΒΙ»κ”–“χΨΒΒΡ ‘Ιή÷–Θ§‘Φ1minΚσ“χΨΒΆξ»Ϊ»ήΫβΓΘ
Θ®5Θ© Ι“χΨΒ»ήΫβΒΡ‘≠“ρΩ…Ρή”–ΝΫΗωΘΚa.NO3(H+) Ι“χΨΒ»ήΫβΘΜb.__ Ι“χΨΒ»ήΫβΓΘΈΣ÷ΛΟςb≥…ΝΔΘ§…ηΦΤ»γœ¬ΖΫΑΗΘΚ»Γ…ΌΝΩ“χΨΒ»ήΫβΚσΒΡ»ή“Κ”ΎΝμ“Μ÷ß ‘Ιή÷–Θ§___ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΜ·―ß–η―θΝΩ(chemical oxygen demandΘ§Φρ≥ΤCOD)±μ Ψ‘Ύ«ΩΥα–‘ΧθΦΰœ¬÷ΊΗθΥαΦΊ―θΜ· 1 L ΈέΥ°÷–”–ΜζΈοΥυ–ηΒΡ―θΜ·ΦΝΒΡΝΩΘ§≤ΔΜΜΥψ≥…“‘―θΤχΈΣ―θΜ·ΦΝ ±Θ§1 LΥ°―υΥυœϊΚΡO2ΒΡ÷ ΝΩ(mgΓΛL-1)ΦΤΥψΓΘCOD–ΓΘ§Υ°÷ ΚΟΓΘΡ≥ΚΰΟφ≥ωœ÷≥ύ≥±Θ§Ρ≥Μ·―ß–Υ»Λ–ΓΉιΈΣ≤βΕ®ΤδΈέ»Ψ≥ΧΕ»Θ§”Ο 1.176 g K2Cr2O7ΙΧΧε≈δ÷Τ≥… 100 mL»ή“ΚΘ§œ÷»ΓΥ°―υ20.00 mLΘ§Φ”»κ10.00 mL K2Cr2O7»ή“ΚΘ§≤ΔΦ”»κ ΝΩΥαΚΆ¥ΏΜ·ΦΝΘ§Φ”»»Ζ¥”Π2 hΓΘΕύ”ύΒΡK2Cr2O7”Ο0.100 0 molΓΛL-1Fe(NH4)2(SO4)2»ή“ΚΫχ––ΒΈΕ®Θ§œϊΚΡFe(NH4)2(SO4)2»ή“ΚΒΡΧεΜΐ»γœ¬±μΥυ ΨΓΘ¥Υ ±Θ§ΖΔ…ζΒΡΖ¥”Π «CrO72-+6Fe2ΘΪ+14H+=2Cr3ΘΪ+6Fe3++7H2OΓΘ(“―÷ΣK2Cr2O7ΚΆ”–ΜζΈοΖ¥”Π ±±ΜΜΙ‘≠ΈΣ Cr3+Θ§K2Cr2O7ΒΡœύΕ‘Ζ÷Ή”÷ ΝΩΈΣ294)
–ρΚ≈ | Τπ ΦΕΝ ΐ/mL | ÷’ΒψΕΝ ΐ/mL |
1 | 0.00 | 12.10 |
2 | 1.26 | 13.16 |
3 | 1.54 | 14.64 |
(1)K2Cr2O7»ή“ΚΒΡΈο÷ ΒΡΝΩ≈®Ε»ΈΣ______molΓΛL-1ΓΘ
(2)«σΗΟΚΰΥ°ΒΡCODΈΣ______mgΓΛL-1ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com