
【题目】化学需氧量(chemical oxygen demand,简称COD)表示在强酸性条件下重铬酸钾氧化 1 L 污水中有机物所需的氧化剂的量,并换算成以氧气为氧化剂时,1 L水样所消耗O2的质量(mg·L-1)计算。COD小,水质好。某湖面出现赤潮,某化学兴趣小组为测定其污染程度,用 1.176 g K2Cr2O7固体配制成 100 mL溶液,现取水样20.00 mL,加入10.00 mL K2Cr2O7溶液,并加入适量酸和催化剂,加热反应2 h。多余的K2Cr2O7用0.100 0 mol·L-1Fe(NH4)2(SO4)2溶液进行滴定,消耗Fe(NH4)2(SO4)2溶液的体积如下表所示。此时,发生的反应是CrO72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。(已知K2Cr2O7和有机物反应时被还原为 Cr3+,K2Cr2O7的相对分子质量为294)
序号 | 起始读数/mL | 终点读数/mL |
1 | 0.00 | 12.10 |
2 | 1.26 | 13.16 |
3 | 1.54 | 14.64 |
(1)K2Cr2O7溶液的物质的量浓度为______mol·L-1。
(2)求该湖水的COD为______mg·L-1。
【答案】0.0400 480
【解析】
(1)根据n=![]() 及c=
及c=![]() 计算K2Cr2O7溶液的物质的量浓度;
计算K2Cr2O7溶液的物质的量浓度;
(2)根据CrO72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,计算剩余的K2Cr2O7的物质的量,进而计算水样消耗的n(K2Cr2O7);再根据电子转移守恒计算水样消耗氧气的物质的量,及计算水样的化学需氧量,据此解答。
(1)K2Cr2O7的摩尔质量为294 g/mol,则1.176 g K2Cr2O7固体的物质的量是n(K2Cr2O7)=![]() =0.0040 mol,由于配制成100 mL溶液,所以配制K2Cr2O7的溶液的物质的量浓度c(K2Cr2O7)=
=0.0040 mol,由于配制成100 mL溶液,所以配制K2Cr2O7的溶液的物质的量浓度c(K2Cr2O7)=![]() =0.0400 mol/L;
=0.0400 mol/L;
(2)n(K2Cr2O7)=0.01 L×0.0400 mol/L=4×10-4 mol,三次实验消耗溶液的体积分别是12.10 mL、11.90mL、13.10 mL,可见第三次实验误差较大,要舍去,则消耗溶液平均体积是V=![]() =12.00 mL、n(Fe2+)=12×10-3 L×0.10 mol/L=1.2×10-3 mol,由CrO72-+6Fe2++14H+=2Cr3++6Fe3++7H2O可知,剩余的n(K2Cr2O7)=
=12.00 mL、n(Fe2+)=12×10-3 L×0.10 mol/L=1.2×10-3 mol,由CrO72-+6Fe2++14H+=2Cr3++6Fe3++7H2O可知,剩余的n(K2Cr2O7)=![]() n(Fe2+)=
n(Fe2+)=![]() ×1.2×10-3 mol=2×10-4 mol,则水样消耗的n(K2Cr2O7)=4×10-4 mol-2×10-4 mol=2×10-4 mol,根据电子电子转移可知,水样需要氧气的物质的量为n(O2)=
×1.2×10-3 mol=2×10-4 mol,则水样消耗的n(K2Cr2O7)=4×10-4 mol-2×10-4 mol=2×10-4 mol,根据电子电子转移可知,水样需要氧气的物质的量为n(O2)=![]() ×[2×10-4mol×(6-3)×2]=3×10-4 mol,氧气的质量m(O2)=3×10-4 mol×32 g/mol=96×10-4 g=9.6 mg,故该水样的化学需氧量COD=
×[2×10-4mol×(6-3)×2]=3×10-4 mol,氧气的质量m(O2)=3×10-4 mol×32 g/mol=96×10-4 g=9.6 mg,故该水样的化学需氧量COD=![]() =480 mg/L。
=480 mg/L。


科目:高中化学 来源: 题型:
【题目】燃煤烟气中含有一定量的二氧化硫,会造成大气污染。一定条件下,通过下列反应可以实现燃煤烟气中硫的回收:2CO(g)+SO2(g)![]() 2CO2(g)+S(l) H, 请回答:
2CO2(g)+S(l) H, 请回答:
⑴已知CO(g)+![]() O2(g)=CO2(g) △H1=-a kJ·mol-1
O2(g)=CO2(g) △H1=-a kJ·mol-1
S(s)+O2(g)=SO2(g) H2=-b kJ·mol-1
S(l)=S(s) H3=-c kJ·mol-1
则△H=_______kJ·mol-1。
⑵一定温度下,向2L恒容密闭容器中通入2molCO和1molSO2,在不同条件下进行反应:2CO(g)+SO2(g)![]() 2CO2(g)+S(l),反应体系总压强随时间的变化如图所示:
2CO2(g)+S(l),反应体系总压强随时间的变化如图所示:
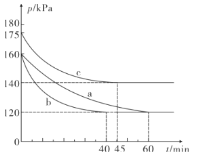
①图中三组实验从反应开始至达到平衡时的反应速率v(CO)由大到小的次序为___( 填实验序号); 与a组相比,c组改变的实验条件可能是___。
②若b组反应进行到40min时达到平衡状态,此时测得容器中气体的密度比反应前减少了12.8 g·L-1,则CO的物质的量浓度c(CO)=___,反应在此条件下的化学平衡常数K=___
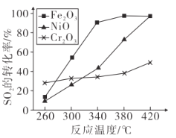
⑶其他条件相同、催化剂不同时,SO,的转化率随反应温度的变化如下图,260°C时,______(填Fe2O3、NiO或Cr2O3)作催化剂反应速率最快;Fe2O3和NiO作催化剂均使SO2的转化率达到最高,不考虑价格因素,选择Fe2O3的主要优点是_______。
⑷SO2—O2质子交换膜燃料电池实现了制硫酸、发电、环保三项目标,此电池的负极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述不正确的是( )
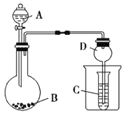
A.若A为浓盐酸,B为KMnO4,C中盛品红溶液,则C中溶液褪色
B.若A为醋酸,B为贝壳,C中盛Na2SiO3,则C中溶液中变浑浊
C.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生沉淀后沉淀又溶解
D.实验仪器D可以起到防止溶液倒吸的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.由三种元素组成的化合物A,按如下流程进行实验。
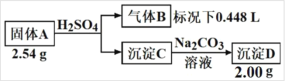
气体B为黄绿色气体单质, 沉淀C和D焰色反应为均为砖红色。
(1)组成A的三种元素是______,A的化学式是______
(2)固体A与足量稀硫酸反应的化学方程式是______。
(3)请从化学反应原理的角度解释(结合化学方程式)为什么沉淀C能转化成 D______。
Ⅱ.常用的补铁剂有硫酸亚铁等,而乳酸亚铁被人体吸收的效果比无机铁好,它溶于水形成淡绿色的透明溶液,几乎不溶于乙醇。它的制备方法有两种:一是在FeCO3中加入乳酸;二是利用废铁屑制取纯净的三水合乳酸亚铁晶体,其实验流程如下图所示:
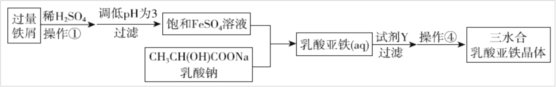
(1)写出制备方法一的离子反应方程式_______;
(2)操作①中不需要用到的仪器为________;
A.玻璃棒 B.坩埚 C.坩埚钳 D.蒸发皿
(3)加入过量的试剂Y为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA表示阿伏加德罗常数的值)( )
A. 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA
B. 标准状况下,18 g H2O所占的体积约是22.4 L
C. 32 g O2在标准状况下所占的体积约为22.4 L
D. 2.4g金属镁变为镁离子时失去的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。该装置工作时,下列说法不正确的是

A. 甲为正极,丙为阴极
B. 丁极的电极反应式为MnO42――e-===MnO4-
C. KOH溶液的质量分数:c%>a%>b%
D. 标准状况下,甲电极上每消耗22.4L气体时,理论上有4molK+移入阴极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0,
通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,弃去浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计的装置示意图如下图所示。
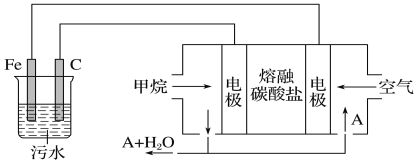
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的________。
a.H2SO4 b.CH3CH2OH c.Na2SO4 d.NaOH
(2)电解过程中,电解池阳极发生了两个电极反应,其中一个为2H2O-4e-=O2↑+4H+,则另一个电极反应式为_____________________________。
(3)电解池溶液中得到Fe(OH)3沉淀的离子方程式为_____________________________。
(4)熔融盐燃料电池以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料为电极。
①正极的电极反应式为______________________________________;
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。则A物质的化学式是___________。
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中所用少量氯气是用MnO2和浓盐酸制取的,用浓盐酸200ml,其密度为1.19g·cm-3,HCl的质量分数为36.5%,跟MnO2恰好完全反应,产生了11.2L(标况)的氯气。试计算:
①浓盐酸的物质的量浓度?___
②求参加反应的HCl的物质的量?___
③被氧化的HCl的质量?___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H= -746.4 kJ·mol-1。起始反应时 NO和CO各为 4 mol,10 秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
N2(g)+2CO2(g) △H= -746.4 kJ·mol-1。起始反应时 NO和CO各为 4 mol,10 秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
A. 反应前5秒钟内,用NO表示的平均反应速率为0.lmol·L-1·s-1
B. 达到平衡后,升髙温度,正反应速率将减小,逆反应速率将增大
C. 达到平衡后,反应速率的关系有:V正(CO)=2v逆(N2)
D. 保持容器体积不变,往容器中充入1 mol O2,正、逆反应速率都不改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com