
【题目】电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0,
通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,弃去浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计的装置示意图如下图所示。
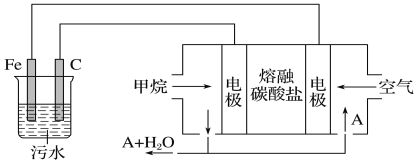
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的________。
a.H2SO4 b.CH3CH2OH c.Na2SO4 d.NaOH
(2)电解过程中,电解池阳极发生了两个电极反应,其中一个为2H2O-4e-=O2↑+4H+,则另一个电极反应式为_____________________________。
(3)电解池溶液中得到Fe(OH)3沉淀的离子方程式为_____________________________。
(4)熔融盐燃料电池以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料为电极。
①正极的电极反应式为______________________________________;
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。则A物质的化学式是___________。
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)________L。
【答案】c Fe-2e-===Fe2+ 4Fe2++10H2O+O2===4Fe(OH)3↓+8H+或4Fe2++4H++O2===4Fe3++2H2O,Fe3++3OH-===Fe(OH)3↓ O2+2CO2+4e-===2CO32-(或2O2+4CO2+8e-===4CO32-) CO2 11.2
【解析】
A装置为电解池,B装置为原电池装置,原电池工作时,通入甲烷的一级为负极,发生氧化反应,负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,通入氧气的一极为正极,发生还原反应,正极反应为O2+2CO2+4e-=2CO32-,电解池中Fe为阳极,发生Fe-2e-=Fe2+,阴极的电极反应为:2H++2e-=H2↑,二价铁离子具有还原性,能被氧气氧化到正三价,4Fe2++10H2O+O2=4Fe(OH)3↓+8H+。
(1)由题意可知,保持保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀时,加入能使溶液导电能力增强的电解质,必须是可溶于水的、显中性的盐,故选c,故答案为:c;
(2)燃料电池中通入空气的电极是正极,通入甲烷的电极是负极,铁与正极相连作阳极,活泼金属电极做电解池的阳极时,电极本身失去电子,电极反应式为Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+;
(3)阳极铁失去电子转化为亚铁离子,亚铁离子具有还原性,能被氧气氧化生成铁离子,铁离子与氢氧根离子结合生成氢氧化铁红褐色沉淀,反应的离子方程式可表示为4Fe2++10H2O+O2=4Fe(OH)3↓+8H+,故答案为:4Fe2++10H2O+O2=4Fe(OH)3↓+8H+;
(4)①燃料电池中,正极得到电子发生还原反应,即一定是氧气得电子的过程。由于电解质是熔融碳酸盐,因此正极电极反应为O2+2CO2+4e-=2CO32-,故答案为:O2+2CO2+4e-=2CO32-;
②负极甲烷失去电子转化为CO2,而正极需要消耗CO2,所以可以循环利用的物质是CO2,故答案为:CO2;
(5)阴极电极反应为2H++2e-=H2↑,即44.8L(标准状况)气体是氢气,物质的量是2mol,转移电子的物质的量为4mol。根据电池的负极电极反应CH4+4CO32--8e-=5CO2+2H2O可知当转移4mol电子时,消耗CH40.5mol,在标准状况下的体积V=0.5mol×22.4L/mol=11.2L,故答案为:11.2。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】N2分子在催化剂的作用下发生的一系列转化如图所示。下列叙述正确的是( )
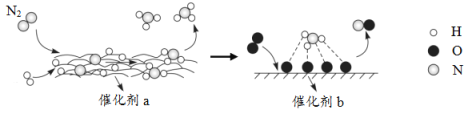
A.![]() 在反应过程中作催化剂
在反应过程中作催化剂
B.催化剂a表面发生了分解反应和化合反应
C.催化剂a、b增大了该历程中的最大能垒(活化能)
D.催化剂b表面发生的反应为:4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,用Fe2O3、NiO或Cr2O3作催化剂对燃煤烟气进行回收,使SO2转化生成S。催化剂不同,其他条件相同(浓度、温度、压强)情况下, 相同时间内SO2的转化率随反应温度的变化如下图,下列说法不正确的是
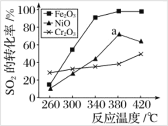
A.不考虑催化剂价格因素,选择Fe2O3作催化剂可以节约能源
B.选择Fe2O3作催化剂,最适宜温度为340 ℃左右
C.a 点后SO2的转化率减小的原因可能是温度升高催化剂活性降低了
D.其他条件相同的情况下,选择Cr2O3作催化剂,SO2的平衡转化率最小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学需氧量(chemical oxygen demand,简称COD)表示在强酸性条件下重铬酸钾氧化 1 L 污水中有机物所需的氧化剂的量,并换算成以氧气为氧化剂时,1 L水样所消耗O2的质量(mg·L-1)计算。COD小,水质好。某湖面出现赤潮,某化学兴趣小组为测定其污染程度,用 1.176 g K2Cr2O7固体配制成 100 mL溶液,现取水样20.00 mL,加入10.00 mL K2Cr2O7溶液,并加入适量酸和催化剂,加热反应2 h。多余的K2Cr2O7用0.100 0 mol·L-1Fe(NH4)2(SO4)2溶液进行滴定,消耗Fe(NH4)2(SO4)2溶液的体积如下表所示。此时,发生的反应是CrO72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。(已知K2Cr2O7和有机物反应时被还原为 Cr3+,K2Cr2O7的相对分子质量为294)
序号 | 起始读数/mL | 终点读数/mL |
1 | 0.00 | 12.10 |
2 | 1.26 | 13.16 |
3 | 1.54 | 14.64 |
(1)K2Cr2O7溶液的物质的量浓度为______mol·L-1。
(2)求该湖水的COD为______mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是( )
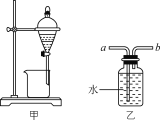
A.用装置甲分液时,两层液体应依次从下口放出
B.用装置乙除去NO中混有的少量NO2时,应将混合气体从a管通入
C.中和滴定时,锥形瓶应先用待测液润洗2~3次
D.配制溶液时加水超过容量瓶的刻度线,应立即用胶头滴管吸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的电解装置可实现低电位下高效催化还原CO2。下列说法不正确的是( )
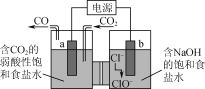
A.a极连接外接电源的负极
B.电解过程中Na+从右池移向左池
C.b极的电极反应式为Cl--2e-+H2O=ClO-+2H+
D.外电路上每转移1 mol电子,理论可催化还原标况下CO2气体11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究Na2SO3溶液和KIO3溶液的反应。
实验I:向某浓度的KIO3酸性溶液(过量)中加入Na2SO3溶液(含淀粉),一段时间(t秒)后,溶液突然变蓝。
资料:IO3-在酸性溶液氧化I-,反应为IO3- + 5I- + 6H+ = 3I2 + 3H2O
(1)溶液变蓝,说明Na2SO3具有_________性。
(2)针对t秒前溶液未变蓝,小组做出如下假设:
i.t秒前未生成I2,是由于反应的活化能______(填“大”或“小”),反应速率慢导致的。
ii.t秒前生成了I2,但由于存在Na2SO3,_____(用离子方程式表示),I2被消耗。
(3)下述实验证实了假设ii合理。
实验II:向实验I的蓝色溶液中加入_______,蓝色迅速消失,后再次变蓝。
(4)进一步研究Na2SO3溶液和KIO3溶液反应的过程,装置如下。
实验III:K闭合后,电流表的指针偏转情况记录如下表:
表盘 | |
| ||
时间/min | 0~t1 | t2~t3 | t4 | |
偏转 位置 | 右偏至Y | 指针回到“0”处,又返至“X”处;如此周期性往复多次…… | 指针 归零 | |
① K闭合后,取b极区溶液加入盐酸酸化的BaCl2溶液,现象是______。
② 0~t1时,从a极区取溶液于试管中,滴加淀粉溶液,溶液变蓝;直接向a极区滴加淀粉溶液,溶液未变蓝。判断IO3- 在a极放电的产物是_______。
③ 结合反应解释t2~t3时指针回到“0”处的原因:________。
(5)综合实验I、II、III,下列说法正确的是_______。
A.对比实验I、II,t秒后溶液变蓝,I中SO32-被完全氧化
B.对比实验I、III,t秒前IO3- 未发生反应
C.实验III中指针返回X处的原因,可能是I2氧化SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2V L Fe2(SO4)3溶液中含有a g SO42—,取此溶液V L,用水稀释至2V L,则稀释后溶液中Fe3+的物质的量浓度为
A.![]() mol·L-1B.
mol·L-1B.![]() mol·L-1C.
mol·L-1C.![]() mol·L-1D.
mol·L-1D.![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:
MnO2熔融氧化:3MnO2+ KClO3+ 6KOH ![]() 3K2MnO4+ KCl+3H2O ;
3K2MnO4+ KCl+3H2O ;
K2MnO4歧化:3K2MnO4+ 2CO2=2KMnO4+ MnO2↓+2K2CO3 。
已知K2MnO4溶液显绿色。请回答下列问题:
(1)MnO2熔融氧化应放在_______________中加热(填仪器编号)。
①烧杯 ②瓷坩埚 ③蒸发皿 ④铁坩埚
(2)在MnO2熔融氧化所得产物的热浸取液中通入CO2气体,使K2MnO4歧化的过程在如图装置中进行,A、B、C、D、E为旋塞,F、G为气囊,H为带套管的玻璃棒。
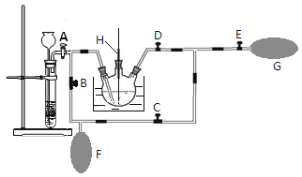
①为了能充分利用CO2,装置中使用了两个气囊。当试管内依次加入块状碳酸钙和盐酸后,关闭旋塞B、E,微开旋塞A, 打开旋塞C、D,往热K2MnO4溶液中通入CO2气体,未反应的CO2被收集到气囊F中。待气囊F收集到较多气体时,关闭旋塞__________,打开旋塞____________,轻轻挤压气囊F,使CO2气体缓缓地压入K2MnO4溶液中再次反应,未反应的CO2气体又被收集在气囊G中。然后将气囊G中的气体挤压入气囊F中,如此反复,直至K2MnO4完全反应。
②检验K2MnO4歧化完全的实验操作是_______________________________________。
(3)将三颈烧瓶中所得产物进行抽滤,将滤液倒入蒸发皿中,蒸发浓缩至____________,自然冷却结晶,抽滤,得到针状的高锰酸钾晶体。本实验应采用低温烘干的方法来干燥产品,原因是________________。
(4)利用氧化还原滴定法进行高锰酸钾纯度分析,原理为:2MnO4-+5C2O42+16H+=2Mn2++10CO2↑+8H2O
现称取制得的高锰酸钾产品7.245g,配成500mL溶液,用移液管量取25.00 mL待测液,用0.1000 mol·L-1草酸钠标准溶液液进行滴定,终点时消耗标准液体积为50.00mL(不考虑杂质的反应),则高锰酸钾产品的纯度为_________(保留4位有效数字,已知M(KMnO4)=158g·mol-1)。若移液管用蒸馏水洗净后没有用待测液润洗或烘干,则测定结果将_________。(填“偏大”、“偏小”、“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com