
【题目】一定条件下,用Fe2O3、NiO或Cr2O3作催化剂对燃煤烟气进行回收,使SO2转化生成S。催化剂不同,其他条件相同(浓度、温度、压强)情况下, 相同时间内SO2的转化率随反应温度的变化如下图,下列说法不正确的是
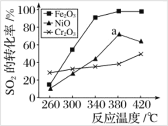
A.不考虑催化剂价格因素,选择Fe2O3作催化剂可以节约能源
B.选择Fe2O3作催化剂,最适宜温度为340 ℃左右
C.a 点后SO2的转化率减小的原因可能是温度升高催化剂活性降低了
D.其他条件相同的情况下,选择Cr2O3作催化剂,SO2的平衡转化率最小
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】按要求写方程式
(1)过氧化钠与水的离子方程式_________________。
(2)氢氧化亚铁在空气中被氧化的化学方程式___________。
(3)氢氟酸刻蚀玻璃的化学方程式____________________。
(4)除去Na2CO3固体中混有的NaHCO3的化学方程式____________。
(5)除去FeCl2溶液中混有的FeCl3的离子方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于区域3的是( )

A.2F2+2H2O═4HF+O2
B.AgNO3+NaCl═AgCl↓+NaNO3
C.3CO+Fe2O3 ![]() 2Fe+3CO2
2Fe+3CO2
D.MgCl2(熔融)![]() Mg+Cl2↑
Mg+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述不正确的是( )
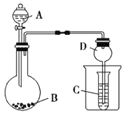
A.若A为浓盐酸,B为KMnO4,C中盛品红溶液,则C中溶液褪色
B.若A为醋酸,B为贝壳,C中盛Na2SiO3,则C中溶液中变浑浊
C.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生沉淀后沉淀又溶解
D.实验仪器D可以起到防止溶液倒吸的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设[aX+bY]为 a 个 X 微粒和 b 个 Y 微粒组成的一个微粒集合体,N(z)为微粒 z 的数量,NA 为阿伏加德罗常数的值。下列说法一定不正确的是
A.C(石墨)+O2(g) = CO2(g) ΔH=-390 kJ·mol1,则每 1 mol [![]() C(石墨)+
C(石墨)+![]() O2(g)]完全燃烧放热 130 kJ
O2(g)]完全燃烧放热 130 kJ
B.Cu 与 1mol/L 的硝酸溶液充分反应,若生成 22.4 L 气体,则转移电子数为 3NA
C.标准状况下 1.6g 氧气含分子数为 0.05NA,且平均每个 O2 分子的体积约为 ![]() L
L
D.1 mol Cl2 与稀 NaOH 溶液完全反应,则反应后的溶液中 N(ClO)+N(HClO)=1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.由三种元素组成的化合物A,按如下流程进行实验。
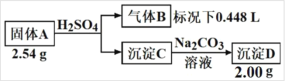
气体B为黄绿色气体单质, 沉淀C和D焰色反应为均为砖红色。
(1)组成A的三种元素是______,A的化学式是______
(2)固体A与足量稀硫酸反应的化学方程式是______。
(3)请从化学反应原理的角度解释(结合化学方程式)为什么沉淀C能转化成 D______。
Ⅱ.常用的补铁剂有硫酸亚铁等,而乳酸亚铁被人体吸收的效果比无机铁好,它溶于水形成淡绿色的透明溶液,几乎不溶于乙醇。它的制备方法有两种:一是在FeCO3中加入乳酸;二是利用废铁屑制取纯净的三水合乳酸亚铁晶体,其实验流程如下图所示:
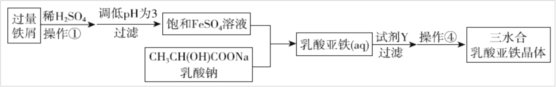
(1)写出制备方法一的离子反应方程式_______;
(2)操作①中不需要用到的仪器为________;
A.玻璃棒 B.坩埚 C.坩埚钳 D.蒸发皿
(3)加入过量的试剂Y为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA表示阿伏加德罗常数的值)( )
A. 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA
B. 标准状况下,18 g H2O所占的体积约是22.4 L
C. 32 g O2在标准状况下所占的体积约为22.4 L
D. 2.4g金属镁变为镁离子时失去的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0,
通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,弃去浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计的装置示意图如下图所示。
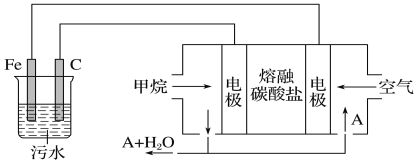
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的________。
a.H2SO4 b.CH3CH2OH c.Na2SO4 d.NaOH
(2)电解过程中,电解池阳极发生了两个电极反应,其中一个为2H2O-4e-=O2↑+4H+,则另一个电极反应式为_____________________________。
(3)电解池溶液中得到Fe(OH)3沉淀的离子方程式为_____________________________。
(4)熔融盐燃料电池以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料为电极。
①正极的电极反应式为______________________________________;
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。则A物质的化学式是___________。
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究含硒工业废水的处理工艺,对控制水体中硒超标具有重要意义。
(1)已知:H2SeO3为二元弱酸,Ka1(H2SeO3)=3.5×10-3,Ka2(H2SeO3)=5.0×10-8。用离子交换树脂处理含Na2SeO3浓度较高的废水时,发生的交换反应为SeO32-+2RCl=R2SeO3+2Cl- (R为离子交换树脂的树脂骨架)。经离子交换法处理后,废水的pH将________(填“增大”“减小”或“不变”)。
(2)木炭包覆纳米零价铁除硒法是一种改良的含硒废水处理方法。
①以木屑和FeCl3·6H2O为原料,在N2氛围中迅速升温至600 ℃,保持2 h,过程中木屑先转化为木炭,最终制得木炭包覆纳米零价铁。制备木炭包覆纳米零价铁过程中,木炭的作用有吸附和________________________________________。
②木炭包覆纳米零价铁在碱性废水中形成许多微电池,加速SeO32-的还原过程。SeO32-在微电池正极上转化为单质Se,其电极反应式为________。
(3) 绿锈[FeaⅡFebⅡ(OH)cXd](X代表阴离子,Ⅱ、Ⅲ表示铁元素的价态)中铁元素以结构态和游离态两种形式存在。由于结构态的双金属氢氧化物层间存在较大的空隙,形成了巨大的比表面积,同时结构态的FeⅡ还原能力优于游离态的FeⅡ,使得绿锈成为一种良好的除硒剂。
①结构态的绿锈具有优异的吸附性能,而且游离态的Fe3+还易水解生成Fe(OH)3胶体进一步吸附SeO32-。写出Fe3+水解的离子方程式:________。
②不同FeⅡ/FeⅢ组成的绿锈对SeO32-去除效果的影响结果如图1所示。随着绿锈组成中FeⅡ/FeⅢ比值的增大,绿锈的除硒效果先减小后增大的原因可能是________。
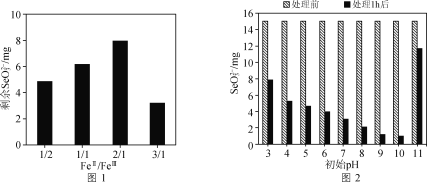
③废水的初始pH会对绿锈去除SeO32-的效果产生影响,关系如图2所示。当初始pH增大至11时,SeO32-的去除效果突然迅速减小的原因是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com