
【题目】N2分子在催化剂的作用下发生的一系列转化如图所示。下列叙述正确的是( )
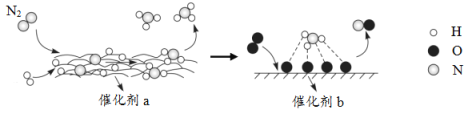
A.![]() 在反应过程中作催化剂
在反应过程中作催化剂
B.催化剂a表面发生了分解反应和化合反应
C.催化剂a、b增大了该历程中的最大能垒(活化能)
D.催化剂b表面发生的反应为:4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)向沸水中逐滴滴加1 mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是____________nm。
(2)电子工业需要用30 %的FeCl3溶液腐蚀敷在绝缘板上的铜片制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式______________________________________。某同学对FeCl3腐蚀铜后所得溶液的组成进行测定:取少量待测溶液,滴入KSCN溶液呈红色,则溶液中所含金属阳离子有________________。
(3)若要验证该溶液中含有Fe2+,正确的实验方法是________(用字母代号填)。
A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe2+。
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+。
C.向试管中加入试液,先滴入KSCN溶液,无现象,再滴加氯水,若显血红色,证明原溶液中含有Fe2+
(4)欲从废液中回收铜,并重新获得FeCl3溶液设计实验方案如下:
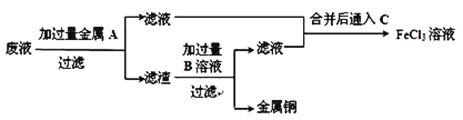
①写出上述实验中有关物质的化学式:A:__________;B:__________。
②写出通入 C的化学方程式_____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写方程式
(1)过氧化钠与水的离子方程式_________________。
(2)氢氧化亚铁在空气中被氧化的化学方程式___________。
(3)氢氟酸刻蚀玻璃的化学方程式____________________。
(4)除去Na2CO3固体中混有的NaHCO3的化学方程式____________。
(5)除去FeCl2溶液中混有的FeCl3的离子方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤烟气中含有一定量的二氧化硫,会造成大气污染。一定条件下,通过下列反应可以实现燃煤烟气中硫的回收:2CO(g)+SO2(g)![]() 2CO2(g)+S(l) H, 请回答:
2CO2(g)+S(l) H, 请回答:
⑴已知CO(g)+![]() O2(g)=CO2(g) △H1=-a kJ·mol-1
O2(g)=CO2(g) △H1=-a kJ·mol-1
S(s)+O2(g)=SO2(g) H2=-b kJ·mol-1
S(l)=S(s) H3=-c kJ·mol-1
则△H=_______kJ·mol-1。
⑵一定温度下,向2L恒容密闭容器中通入2molCO和1molSO2,在不同条件下进行反应:2CO(g)+SO2(g)![]() 2CO2(g)+S(l),反应体系总压强随时间的变化如图所示:
2CO2(g)+S(l),反应体系总压强随时间的变化如图所示:
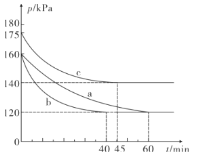
①图中三组实验从反应开始至达到平衡时的反应速率v(CO)由大到小的次序为___( 填实验序号); 与a组相比,c组改变的实验条件可能是___。
②若b组反应进行到40min时达到平衡状态,此时测得容器中气体的密度比反应前减少了12.8 g·L-1,则CO的物质的量浓度c(CO)=___,反应在此条件下的化学平衡常数K=___
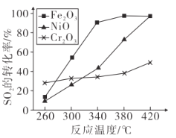
⑶其他条件相同、催化剂不同时,SO,的转化率随反应温度的变化如下图,260°C时,______(填Fe2O3、NiO或Cr2O3)作催化剂反应速率最快;Fe2O3和NiO作催化剂均使SO2的转化率达到最高,不考虑价格因素,选择Fe2O3的主要优点是_______。
⑷SO2—O2质子交换膜燃料电池实现了制硫酸、发电、环保三项目标,此电池的负极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸(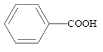 )广泛应用于制药和化工行业。某小组同学尝试利用甲苯(
)广泛应用于制药和化工行业。某小组同学尝试利用甲苯(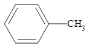 )的氧化反应制备苯甲酸,反应原理为:
)的氧化反应制备苯甲酸,反应原理为:
 +2KMnO4
+2KMnO4![]()
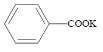 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
 +HCl
+HCl![]()
 +KCl
+KCl
相关物质的部分信息如下表:
名称 | 相对分子质量 | 性状 | 熔点/℃ | 沸点/℃ | 密度 /gmL-1 | 溶解度 | |
4℃冷水 | 75℃热水 | ||||||
甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.87 | 不溶 | 不溶 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.27 | 0.18 | 2.20 |
实验装置(部分夹持装置已略去)和流程如下:
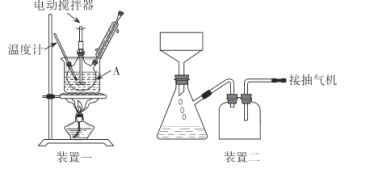
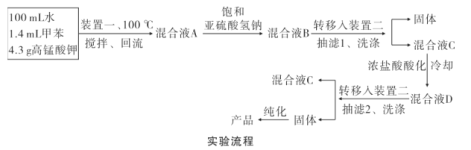
请回答:
(1)装置一中A的名称为___,在本实验中,下列规格的A中最合适的是___(填字母)。
A.50 mL B.100mL C.150 mL D.250 mL
(2)相对于用酒精灯直接加热,用热水浴加热的优点是_____。
(3)判断甲苯被氧化完全的实验现象是_____。
(4)抽滤可利用装置二完成,抽滤的优点是____。抽滤1后洗涤固体应选___(填序号,下同),抽滤2后洗涤固体应选_____。
A.4 °C冷水 B.75 °C热水 C.A和B均可
(5)混合液A中加入适量饱和亚硫酸氢钠溶液的目的是_____,若不加入,产生的主要问题是____。
(6)纯化固体时可采用的物理方法的名称是___。
(7)若加入1.4 mL甲苯,纯化后所得产品的质量为1.0 g,则苯甲酸的产率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4+5H2C2O4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O
(实验内容及记录)
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol/L H2C2O4 溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | ||
1 | 3.0 | 2.0 | 1.0 | 2.0 | 4.0 |
2 | 2.0 | 3.0 | 1.0 | 2.0 | 5.2 |
3 | 1.0 | 4.0 | 1.0 | 2.0 | 6.4 |
请回答:
(1)根据表中的实验数据,可以得到的结论是____。
(2)利用实验1中数据计算,所在时间内用KMnO4的浓度变化表示的平均反应速率为:v(KMnO4)=____。
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
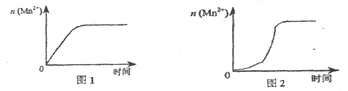
①该小组同学提出的假设是____。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol/LH2C2O4溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | |||
4 | 3.0 | 2.0 | 1.0 | 2.0 | ___ | t |
③若该小组同学提出的假设成立,应观察到的现象是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于区域3的是( )

A.2F2+2H2O═4HF+O2
B.AgNO3+NaCl═AgCl↓+NaNO3
C.3CO+Fe2O3 ![]() 2Fe+3CO2
2Fe+3CO2
D.MgCl2(熔融)![]() Mg+Cl2↑
Mg+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述不正确的是( )
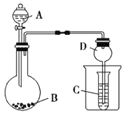
A.若A为浓盐酸,B为KMnO4,C中盛品红溶液,则C中溶液褪色
B.若A为醋酸,B为贝壳,C中盛Na2SiO3,则C中溶液中变浑浊
C.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生沉淀后沉淀又溶解
D.实验仪器D可以起到防止溶液倒吸的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0,
通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,弃去浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计的装置示意图如下图所示。
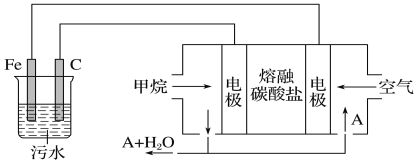
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的________。
a.H2SO4 b.CH3CH2OH c.Na2SO4 d.NaOH
(2)电解过程中,电解池阳极发生了两个电极反应,其中一个为2H2O-4e-=O2↑+4H+,则另一个电极反应式为_____________________________。
(3)电解池溶液中得到Fe(OH)3沉淀的离子方程式为_____________________________。
(4)熔融盐燃料电池以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料为电极。
①正极的电极反应式为______________________________________;
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。则A物质的化学式是___________。
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com