
����Ŀ�������������ʹ�õĽ���֮һ�����������仯�����֪ʶ������������⡣
��1�����ˮ����εμ�1 mol/L FeCl3��Һ����Һ������ĺ��ɫ���÷�ɢϵ������ֱ���ķ�Χ��____________nm��
��2�����ӹ�ҵ��Ҫ��30 %��FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭƬ����ӡˢ��·�壬��д��FeCl3��Һ��ͭ��Ӧ�����ӷ���ʽ______________________________________��ijͬѧ��FeCl3��ʴͭ��������Һ����ɽ��вⶨ��ȡ����������Һ������KSCN��Һ�ʺ�ɫ������Һ������������������________________��
��3����Ҫ��֤����Һ�к���Fe2������ȷ��ʵ�鷽����________������ĸ�������
A�����Թ��м�����Һ������KSCN��Һ������Ѫ��ɫ��֤������Fe2����
B�����Թ��м�����Һ���������Ը��������Һ������ɫ��֤������Fe2����
C�����Թ��м�����Һ���ȵ���KSCN��Һ���������ٵμ���ˮ������Ѫ��ɫ��֤��ԭ��Һ�к���Fe2��
��4�����ӷ�Һ�л���ͭ�������»��FeCl3��Һ���ʵ�鷽�����£�
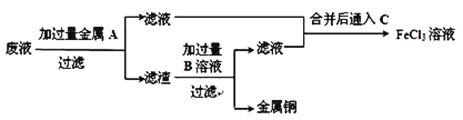
��д������ʵ�����й����ʵĻ�ѧʽ��A��__________��B��__________��
��д��ͨ�� C�Ļ�ѧ����ʽ_____________________________________________
���𰸡�1��100 2Fe3++Cu=2Fe2++Cu2+ Fe3+��Fe2+��Cu2+ BC Fe HCl 2FeCl2+Cl2=2FeCl3
��������
(1)��Һ������ĺ��ɫ�õ��ķ�ɢϵΪ���壻
(2)FeCl3��Һ��ͭ��Ӧ�����Ȼ�ͭ���Ȼ�������ȡ����������Һ������KSCN��Һ�ʺ�ɫ����һ���������ӣ�
(3)��֤����Һ�к���Fe2+�������仹ԭ�ԣ�ע���ų������Ӷ��������Ӽ���ĸ��ţ�
(4)��ʴ��Һ�к����Ȼ�ͭ���Ȼ���������������������Ժ��Ȼ�ͭ��Ӧ���ɽ���ͭ���Ȼ���������AΪFe��������������Һ���Ȼ������������ǽ���ͭ����������ͭ�������ᷴӦ�������������ԣ��������BΪ������Խ�ͭ���룬�õ�����ҺΪ�Ȼ���������Һ�ϲ���ͨ���������ܽ�������������Ϊ���������Դ˽����⡣
(1)���ˮ����εμ�1mol/LFeCl3��Һ����Һ������ĺ��ɫ���÷�ɢϵΪ���壬��֪����ֱ���ķ�Χ��1��100nm��
(2)FeCl3��Һ��ͭ��Ӧ�����Ȼ�ͭ���Ȼ����������ӷ�ӦΪ2Fe3++Cu=2Fe2++Cu2+����ȡ����������Һ������KSCN��Һ�ʺ�ɫ����һ���������ӣ���Cu���㣬��Һ�л���Fe2+��Cu2+��
(3)A�����Թ��м�����Һ������KSCN��Һ������Ѫ��ɫ��֤������Fe3+�����ܼ���Fe2+����A����
B�����Թ��м�����Һ���������Ը��������Һ������ɫ������������ԭ��Ӧ������Fe2+��ԭ�ԣ�֤������Fe2+����B��ȷ��
C�����Թ��м�����Һ�ȵ���KSCN��Һ�����Ժ�ɫ���ٵμ���ˮ����Ѫ��ɫ��֤��ԭ��Һ�к���Fe2����
�ʴ�Ϊ��BC��
(4)��ʴ��Һ�к����Ȼ�ͭ���Ȼ���������������������Ժ��Ȼ�ͭ��Ӧ���ɽ���ͭ���Ȼ���������AΪFe��������������Һ���Ȼ������������ǽ���ͭ����������ͭ�������ᷴӦ�������������ԣ��������BΪ������Խ�ͭ���룬�õ�����ҺΪ�Ȼ���������Һ�ϲ���ͨ���������ܽ�������������Ϊ��������
��������������֪��AΪFe��BΪHCl��
��CΪ������ͨ��C���Ȼ�������Ӧ�����Ȼ���������ʽΪ2FeCl2+Cl2=2FeCl3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. ʯ���ѽ�������ʹ��ˮ��ɫ��Ҳ����ʹ���������Һ��ɫ
B. ���������Ƶ�������ͭ�����Ҵ����Ƿ�����ȩ
C. ��������CH3CH2CH2OH�����Ʒ�ӦҪ��ˮ���Ʒ�Ӧ����
D. CH2=CHCH3+Cl2 ![]() CH2=CHCH2 Cl+ HCl����ȡ����Ӧ
CH2=CHCH2 Cl+ HCl����ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں����ܱ������У���CO�ϳɼ״���CO(g)+2H2(g)![]() CH3OH(g)���������������������£��о��¶ȶԷ�Ӧ��Ӱ�죬ʵ������ͼ��ʾ������˵����ȷ����
CH3OH(g)���������������������£��о��¶ȶԷ�Ӧ��Ӱ�죬ʵ������ͼ��ʾ������˵����ȷ����

A.CO�ϳɼ״��ķ�ӦΪ���ȷ�ӦB.ƽ�ⳣ��![]()
C.�÷�Ӧ��![]() ʱ��ƽ�ⳣ����
ʱ��ƽ�ⳣ����![]() ʱ��СD.����A��ķ�Ӧ��ϵ��
ʱ��СD.����A��ķ�Ӧ��ϵ��![]() �䵽
�䵽![]() ���ﵽƽ��ʱ
���ﵽƽ��ʱ![]() ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��HClO4��H2SO4��HNO3��HCl����ǿ�ᣬ���ǵ�������ˮ��Һ�в��������ij�¶������������ڱ������еĵ��볣����
�� | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6��10��5 | 6.3��10��9 | 1.6��10��9 | 4.2��10��10 |
����˵���в���ȷ����(����)
A.�ڱ��������������ᶼû����ȫ����
B.�ڱ�������HClO4��������������ǿ����
C.�ڱ�������H2SO4�ĵ��뷽��ʽΪH2SO4===2H����SO![]()
D.ˮ�����������������ǿ����������������������������ǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ǻ�ѧ�о��Ļ������������и�ʵ��װ��ͼ����������ȷ����(����)

A. װ�âٳ����ڷ��뻥�����ܵ�Һ̬�����
B. װ�âڿ��������հ���,���ܷ�ֹ����
C. ��װ�â۲�������ɡ���Ȫ��ʵ��
D. ��װ�â�ϡ��Ũ�����ͭ��Ӧ��ȴ��Ļ��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ 100 mL 0.5 mol/LCa(CIO)2��Һ�������л���ͨ��CO2(��ͼ��ʾ��������˵���������
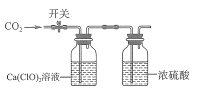
��֪����![]()
����Һ������Ũ�ȿ������¹�ʽ���㣺![]()
![]()
A.0.01 mol CO2ͨ����Һʱ������Ӧ�Ļ�ѧ����ʽΪ![]()
B.ͨ��0.1 mol CO2����HNO3ά����ϵ pH=6����ʱ��Һ������Ũ�ȴ�С��ϵΪc(HCO3-)>c(HCIO)>c(Ca2+)
C.Ѹ��ͨ��0.05 mol CO2�رտ��أ����ú�����ϵ�г�������
D.����ͨ��0.05 mol CO2�Ĺ����У�ˮ�ĵ���̶�һֱ��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1 L 0.1 mol/L�Ĵ�����Һ������ˮϡ�͵�10 L������������ȷ������������
A. c��CH3COOH����Ϊԭ����1/10
B. c��H������Ϊԭ����![]()
C. c��CH3COO����/c��CH3COOH���ı�ֵ����
D. ��Һ�ĵ�������ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ�ص�ҡ������ˮ�к��д���±��Ԫ�ء�NaCl�����ṹʾ��ͼ������ʾ�������߳�Ϊa nm).

(1)Ԫ�� Na�ļ۵��ӱ����������ڸ��ܼ����γɵļ���̬Naԭ�ӣ���۵��ӹ����ʾʽΪ__________��
(2)���� NaCl��Cl Ԫ�ػ����γɶ��ּ�̬�Ļ������NaClO��NaClO2��NaClO3��NaClO4�����������ζ�Ӧ���������������ǿ���Խ���HClO4������ǿ��HClO3��ԭ��__________��
(3)���ʵ������£����NaClˮ��Һ���Ƶ� NaClO3��
��NaClˮ��Һ�д��ڵ�������������________������ţ���
A.���Ӽ� B.���Լ� C.��λ�� D.���
�ڸ��ݼ۲���ӶԻ������ۣ�Ԥ��ClO3-�Ŀռ乹��Ϊ________��д��һ��ClO3-�ĵȵ�����Ļ�ѧ���ţ�______________
(4)��NaCl�����У�Na λ��Cl ��Χ�ɵ���______��������ģ��ö�����ı߳���______nm��
(5)Na �뾶��Cl�뾶�ı�ֵΪ______������С�����3λ��![]() =1.414)��
=1.414)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2�����ڴ����������·�����һϵ��ת����ͼ��ʾ������������ȷ���ǣ� ��
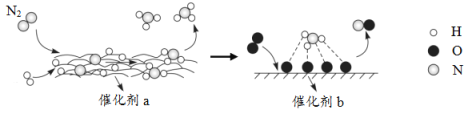
A.![]() �ڷ�Ӧ������������
�ڷ�Ӧ������������
B.����a���淢���˷ֽⷴӦ�ͻ��Ϸ�Ӧ
C.����a��b�����˸������е�������ݣ���ܣ�
D.����b���淢���ķ�ӦΪ��4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com