
【题目】实验室常用乙醇和浓硫酸共热制取乙烯:CH3CH2OH![]() H2C=CH2↑+H2O某同学用以下装置进行乙烯制取实验。下列叙述不正确的是
H2C=CH2↑+H2O某同学用以下装置进行乙烯制取实验。下列叙述不正确的是
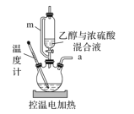
A.m的作用是确保乙醇与浓硫酸能顺利流下
B.电控温值可设置在165-175℃
C.a出来的气体可用瓶口向下排空气法收集
D.烧瓶内可放几粒碎瓷片以防暴沸
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某小组设计实验探究SO2和漂粉精反应原理,装置如图所示。、
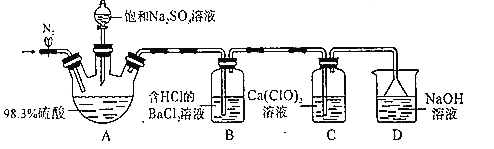
实验操作过程如下:
步骤1:连接装置并检查装置气密性,按如图所示装好药品;
步骤2:打开止水夹,向装置中通入一段时间N2,并关闭止水夹;
步骤3:取下分液漏斗的塞子,旋转活塞,向三颈瓶中滴加饱和Na2SO3溶液。过一会儿,观察到B和C中都产生白色沉淀
步骤4:实验完毕后,检验C中白色固体,白色固体是CaSO4。
回答下列问题:
(1)B装置中盐酸的作用是__;能证明A中产生的“酸雾”含有H2SO4的实验现象是___。
(2)A中硫酸表现出来的性质有__。
(3)步骤2中通入N2的目的是__。
(4)实验完毕后,经检验,D中溶液含有等物质的量浓度的两种还原性盐,写出总反应的离子方程式__。
(5)步骤4检验C中白色沉淀成分的操作是,取少量C中白色固体,滴加足量___(填名称),振荡,白色固体不溶解,则白色固体是CaSO4。
(6)经分析,C中发生化学反应与反应物相对量有关:
若通入少量SO2,则发生反应为3Ca(ClO)2+2SO2+2H2O═2CaSO4↓+4HClO+CaCl2;
若通入过量SO2,则发生反应为Ca(ClO)2+2SO2+2H2O═CaSO4↓+H2SO4+2HCl,SO2+H2OH2SO3。
设计实验证明上述C中通入过量SO2:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
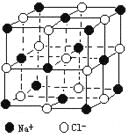
【题目】晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl晶体的晶胞如右图所示。 随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定精确度也越来越高。现有一简单可行的测定方法,具体步骤如下:①将固体食盐研细,干燥后,准确称取m gNaCl固体并转移到定容仪器A中。②用滴定管向仪器A中加苯,并不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为VmL。回答下列问题:
⑴步骤①中A仪器最好用__________________(填仪器名称)。
⑵能否用胶头滴管代替步骤②中的滴定管______,其原因是____________。
⑶能否用水代替苯_______,其原因是______________________。
⑷经X射线衍射测得NaCl晶胞中最邻近的Na+ 和Cl- 平均距离为acm,则利用上述
方法测得的阿伏加德罗常数的表达式为NA=_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于原电池装置Ⅰ若把盐桥(含氯化钾的琼胶)换成粗铜丝,左侧电解质溶液换成硫酸铜溶液,如图Ⅱ所示,两装置均工作一段时间(假设电极材料和电解质溶液均充足,且忽略能量损耗),关于以上两装置说法正确的是( )

A.两装置中锌(a)、锌 (c)两电极均发生氧化反应
B.当装置Ⅰ池铜(b)电极增重64g时,盐桥中转移2mol电子
C.取出Ⅱ装置中粗铜丝小心洗涤干燥称重比原铜丝质量轻
D.I池右侧硫酸铜溶液浓度几乎不变
查看答案和解析>>
科目:高中化学 来源: 题型:
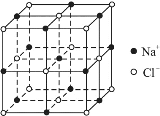
【题目】随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定精确度也越来越高,现有一种简单可行的测定方法,具体步骤为:
(1)将固体NaCl研细、干燥后,准确称取mgNaCl固体并转移到定容仪器A中。
(2)用滴定管向A仪器中滴加苯,不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为Vcm3。
①步骤(1)中A仪器最好用__________(仪器名称)。
②步骤(2)中用酸式滴定管好还是碱式滴定管好,__________,理由是______________。
③能否用胶头滴管代替步骤(2)中的滴定管__________;理由是____________________。
④已知NaCl晶体的结构如上图所示,用X射线测得NaCl晶体中靠得最近的Na+与Cl-间的平均距离为acm,则用上述测定方法测得阿伏加德罗常数NA的表达式为:NA=______mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B、C、D、E、F六种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中最高;F能形成红色(或砖红色)的F2O和黑色的FO两种氧化物。
回答下列问题:
(1)F的原子的M层电子排布式为 。
(2)B、C、D的第一电离能由小到大的顺序为 。(用元素符号表示)
(3)A的简单氢化物分子极易溶于水,其主要原因是 。
(4)E的最高价氧化物分子的空间构型是 ,其中心原子的杂化方式为 。
(5)F的高价离子与A的简单氢化物形成的配离子,不考虑空间构型,配离子的结构可用示意图表示为 。

(6)A、F形成某种化合物的晶胞结构如图所示,则其化学式为 ;(黑色球表示F原子),已知紧邻的白球与黑球之间的距离为a cm,该晶胞的密度为 g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.
(1)W2-离子的结构示意图为______________,E元素在周期表中的位置为____________,写出E的最高价氧化物与D的最高价氧化物的水化物反应的离子方程式____________________。
(2)经测定A2W2为二元弱酸,A2W2的电子式为___________,常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式__________________________。
(3)向含有Fe2+和淀粉KI的酸性溶液中滴入A2W2,观察到溶液呈蓝色并有红褐色沉淀成.当消耗2mol I﹣时,共转移3mol电子,该反应的离子方程式是_____________________。
(4)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,能与水反应放氢气,写出该反应方程式______________________,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是_________L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物。请回答:
(1)Y元素的名称是____________。
(2)XZ3化合物的电子式是______________ 分子的立体构型_______________
(3)分别写出X、Y的最高价含氧酸的分子式_____________、______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种烈化物和两种氧化物。某学习小组在实验用C12和NO制备NOCl并测定其纯度,相关实验(装置略去)如下。请回答:
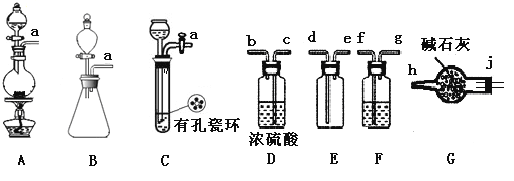
(1)制备Cl2发生装置可______ (填大写字母),反应的离子方程式为_______。
(2)欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→________(按气流方向,用小写字母表示),若用到F,其盛装药品为_________。
(3)实验室可用下图装置制备亚硝酰氯(NOCl)
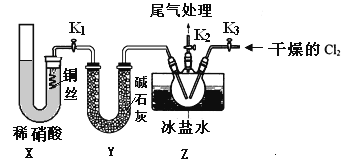
①实验室也可用B装置制备NO,上图X装置的优点为__________(至少写出两点)
②检验装置气密性并装入药品,打开k2,然后再打开____(填“k1”或“k3”),通入一段时间气体,其目的为________,然后进行其他操作,当Z有一定量液体生成时,停止实验。
③若无装肖Y,则Z中NOCl可能发生反应的化学方程式为_________
(4)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL.已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12,则亚硝酰氯(NOC1)的质量分数为____(用代数式表示,不必化简)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com