
某铜矿石中铜元素含量较低,且含有铁、镁、钙等杂质离子。某小组在实验室中用浸出-萃取法制备硫酸铜:
(1)操作I为_______。操作II用到的玻璃仪器有烧杯_______
(2)操作II、操作III的主要目的是_______、富集铜元素。
(3)小组成员利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂Cu2(OH)2CO3悬浊液。多次实验发现所得蓝色悬浊液颜色略有差异,查阅资料表明,可能由于条件控制不同使其中混有较多Cu(OH)2或Cu4(OH)6SO4。
已知Cu(OH)2、Cu2(OH)2CO3、Cu4((OH)6SO4均难溶于水,可溶于酸;分解温度依次为 80℃、200℃、300℃。
设计实验检验悬浊液成分,完成表中内容。
限选试剂:2mol?L-1HCl、1 mol?L-1H2SO4、0.1 mol?L-1NaOH、0.1 mol?L-1 BaCl2、蒸馏水。仪器和用品自选。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,_______________________________________________________________ | 说明悬浊液中混__________________________________________,有Cu4( OH)6SO4。 |
| 步骤2:另取少量悬浊液于试管中,____________________________ | ______________, 说明悬浊液中混有Cu( OH) 2。 |
(17分)
(1)(共4分)管壁内有淡黄色固体生成(2分) 稀释浓硫酸,防止硫化氢被氧化(2分)
(2)(共6分)浓氨水、生石灰(或碱石灰、固体NaOH,4分) 保持集气瓶内外气压平衡(1分),以便左右两边产生的气体顺利导入(1分)
(3)(共7分)①放低(或移动)水准管位置(2分 ),使水准管、量气管内液面相平(2分) ②70.00%(3分)
解析试题分析:(1)依题意,二氧化硫气体与硫化氢气体反应生成单质硫和水,由此推断反应现象为管壁内有淡黄色固体生成、有液滴生成;由于硫化氢能被浓硫酸氧化,则硫化亚铁出加水的目的是稀释浓硫酸,防止稀硫酸与硫化亚铁反应放出的硫化氢气体被浓硫酸氧化;(2)根据二氧化硫的性质推断,右侧Y型管的作用是制取氨气,由于无加热仪器,则选择的试剂为浓氨水液体和生石灰或碱石灰或氢氧化钠固体,产生的氨气溶于BaCl2溶液,得到碱性溶液,再通入二氧化硫气体时,二氧化硫与氨水反应生成亚硫酸铵,亚硫酸铵与BaCl2溶液发生复分解反应,可以得到白色BaSO3沉淀和NH4Cl溶液;导管A的作用是保持集气瓶内外气压平衡,以便左右两边产生的气体顺利导入;(3)读数时,应放低(或移动)水准管位置,使水准管中的液面高于量气管中液面相平,以免造成误差;防止倒吸;设铁镁合金含有xmolFe、ymolMg,根据m=n?M,则①56x+24y=0.080;由于Fe+2HCl=FeCl2+H2↑、Mg+2HCl=MgCl2+H2↑中的系数之比等于物质的量之比,充分反应后得到氢气的物质的量为(x+y)mol;由于初末读数相差(45.80—1.00)mL=(45.80—1.00)×10—3L,说明充分反应后得到氢气的体积为(45.80—1.00)×10—3L;由于n=V/Vm,根据氢气的物质的量相等可得:②x+y =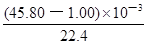 ;解①②可得:x=0.001,y=0.001,则合金中铁的质量为0.056g,镁为0.024g,所以合金中铁的质量分数为
;解①②可得:x=0.001,y=0.001,则合金中铁的质量为0.056g,镁为0.024g,所以合金中铁的质量分数为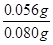 ×100%=70%。
×100%=70%。
考点:考查综合实验和化学计算,涉及实验现象的描述、解释原因、制取氨气的试剂、解释目的、量气方法、物质的量在化学方程式计算中的应用、摩尔质量、气体摩尔体积、质量分数等。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:实验题
海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是________(填序号)
| A.Cl2 | B.淡水 | C.烧碱 | D.食盐 |

 转化为MgCl2的离子方程式是________________________________。
转化为MgCl2的离子方程式是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某同学设计了以下流程检验碳酸钠粉末中可能含有少量氯化钠和氢氧化钠中的一种或两种杂质。
(1)步骤1所需玻璃仪器是 ;步骤3的操作名称是 。
(2)对检验碳酸钠粉末中可能含有的杂质提出合理假设:
假设1:只含有氯化钠
假设2:只含有 。
假设3:氯化钠和氢氧化钠都存在
(3)设计实验方案,进行试验。
限选以下试剂:氯化钡溶液、硝酸钡溶液、酚酞试液、稀硝酸、稀盐酸、稀硫酸、硝酸银溶液。回答下列问题:
①加入过量试剂A的名称是 。
②填写下表:
| 实验步骤 | 预期现象和结论 |
| 步骤4: | |
| 步骤5: | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Al203、Fe及其他不溶于酸、碱的杂质。部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下:
欲从含镍废催化剂中制得NiSO4·7H2O晶体,其流程如下:
请根据以上信息和流程图,回答下列问题:
(1)“碱浸”的目的是除去含镍废催化剂中的___ _。
(2)“酸浸”时所加入的酸是___ _。酸浸后,滤液②中可能含有的金属离子是___ 。(用离子符号表示)。
(3)“调pH为2—3的目的是___ _。
(4)步骤A的操作顺序是加热浓缩、冷却、____、____。
(5)NiSO4在强碱溶液中用NaC1O氧化,可制得碱性镍镉电池电极材料NiOOH。该反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
发酵粉是一种化学膨松剂,可由小苏打、臭粉(碳酸氢铵)、明矾[KAl(SO4)2?12H2O]中的两种物质组成。某小组为探究不同品牌的发酵粉的化学成分,进行如下实验。
【提出假设】
(1)假设1:由小苏打和臭粉组成
假设2:由小苏打和明矾组成
假设3:由__________________________组成
【方案与流程】
为探究甲品牌的发酵粉的成分,某同学设计如下实验,得到如下现象:
(2)结合步骤①~③分析,气体A为________,该发酵粉的成分为__________________。
(3)若步骤①和②操作不变(现象也相同),将步骤③中足量稀盐酸改为足量氯化钡溶液,观察到有白色沉淀生成,能否确定发酵粉的成分并说明理由:________________, ____________________________________________________________________。
(4)乙品牌的发酵粉的化学组成可能为假设2情况,请设计实验验证。
实验仪器和用品任选,限选试剂:稀盐酸、0.1 mol/LNaOH溶液,写出实验步骤、预期现象和结论。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量样品溶于足量的盐酸后, 将溶液分成两份,分别装入A、B试管中。 | |
| 步骤2:_____________________________ __________________________________ | ________________________证明有Na+,发 酵粉中有NaHCO3。 |
| 步骤3:_____________________________ ___________________________________ | ___________________________________ _______,结合步骤2中的结论,假设2成立。 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
工业生产纯碱的过程如下:
完成下列填空:
(1)粗盐水(含杂质离子Mg2+、Ca2+),加入沉淀剂A、B除杂质(A来源于石灰窑厂),则沉淀剂B 的化学式为 。
(2)实验室模拟由滤液制备滤渣的装置如下:
①图1中装置和图2中装置的连接方法为a接 ,b接 ,f接c。
②图2中试剂瓶内发生的化学反应方程式为 。
③实验中要求通入的NH3过量之后再通入CO2气体,检验通入的NH3已过量的实验操作是 。
(3)操作⑤煅烧后的纯碱中含有未分解的碳酸氢钠。某同学称取该纯碱样品m g,再充分加热至质量不再变化时称得剩余固体的质量为n g,则纯碱样品中碳酸钠的质量分数为 。
(4)现有25℃下,0.1mol/LNH3·H2O溶液和0.1mol/LNH4Cl溶液,将两份溶液等体积混合测得溶液的pH=9,下列说法正确的是 (填代号)。
a.0.1mol/L NH4Cl溶液与混合后溶液中导电粒子的种类和数目均相同
b.混合后的溶液中,c(NH3·H2O)>c(Cl-)>c(NH4+)>c(OH-)>c(H+)
c.由题意可知,NH3·H2O的电离程度大于同浓度的NH4Cl的水解程度
d.混合前两份溶液的pH之和大于14
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验是化学的基础。下图为一化学实验装置图,图中,夹持仪器已略去,用“△”表示用酒精灯加热。
请仔细观察该实验装置图,回答问题:
(1)甲装置通入空气的导气管插入乙醇中的主要目的是
(2)乙装置用揉乱的铜丝,好处是
(3)乙装置的化学反应反应方程式为 ,反应中,转移电子的数目是 若有23g乙醇发生反应,至少需要通入标准状况下的空气 L
(4)写出一种检验反应产物的方法及现象
(5)该反应还可以用更简便的方法实现:取一束铜丝在酒精灯上加热,铜丝变黑,趁热插入盛有少量乙醇的试管中,铜丝又变红;如此反复多次即可。请写出实验中发生反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示。下列选项中正确的是
| 选项 | 发生装置中的药品 | 干燥和集气装置 |
| A | 电石和饱和食盐水 | 图2 |
| B | 大理石和稀盐酸 | 图1 |
| C | 铜和稀硝酸 | 图2 |
| D | 氧化钙和浓氨水 | 图1 |

查看答案和解析>>
科目:高中化学 来源: 题型:单选题
图中装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用
于( )
| A.锌和盐酸生成氢气 |
| B.亚硫酸钠和浓硫酸生成二氧化硫 |
| C.碳酸钙和盐酸生成二氧化碳 |
| D.浓氨水和烧碱制取氨气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com