
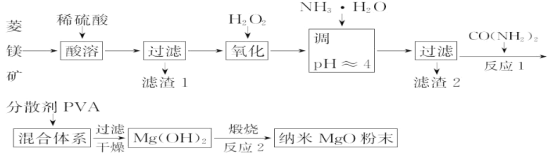
【题目】镁及其化合物有广泛用途。工业上以菱镁矿(主要成分为MgCO3,含SiO2以及少量FeCO3等杂质)为原料制备纳米氧化镁的实验流程如下:
(1)加入H2O2氧化时,发生反应的离子方程式为___。
(2)在实验室煅烧滤渣2制得的金属氧化物为___(填化学式),需要的仪器除酒精灯、三脚架以外,还需要___(填序号)。
①蒸发皿 ②坩埚 ③泥三角 ④石棉网
(3)在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,反应的化学方程式为___。
(4)25℃时,加入CO(NH2)2至开始产生沉淀,溶液的pH=10时,c(Mg2+)=___molL-1(已知25℃,Ksp[Mg(OH)2]=1.8×10-11)。
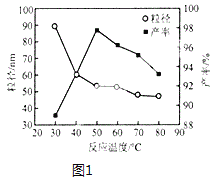
(5)工业上还可用氯化镁和碳酸铵为原料,采用直接沉淀法制备纳米MgO。如图1为反应温度对纳米MgO产率和粒径的影响,据图分析反应的最佳温度为___。
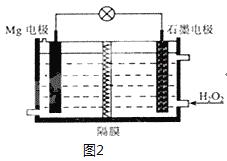
(6)Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图2如。该电池工作时,石墨电极发生的电极反应为___。
【答案】2Fe2++H2O2+2H+=2Fe3++2H2O Fe2O3 ②③ CO(NH2)2+3H2O=CO2↑+2NH3H2O 1.8×10-3 50°C H2O2+2e-=2OH-
【解析】
菱镁矿的主要成分为MgCO3、含SiO2以及少量FeCO3,酸溶时MgCO3、FeCO3与稀硫酸反应生成MgSO4、FeSO4,SiO2与稀硫酸不反应,过滤得到的滤渣1的主要成分为SiO2;向滤液中加入H2O2,H2O2将Fe2+氧化成Fe3+,加入NH3·H2O调pH≈4,Fe3+转化成Fe(OH)3沉淀而除去,滤渣2的主要成分为Fe(OH)3;滤液中加入CO(NH2)2使Mg2+转化为Mg(OH)2沉淀,煅烧Mg(OH)2得到纳米MgO粉末;据此分析作答。
(1)过氧化氢是绿色氧化剂,氧化亚铁离子不会引入新的杂质,氧化亚铁离子的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)滤渣2为氢氧化铁,煅烧氢氧化铁制得的金属氧化物是氧化铁,化学式为Fe2O3,煅烧固体需要在坩埚中进行,需要的仪器除酒精灯、三脚架以外,还需要坩埚、泥三角,答案选②③;
(3)在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,依据原子守恒可知弱碱为一水合氨,反应的化学方程式为:CO(NH2)2+3H2O=CO2↑+2NH3H2O;
(4)已知25℃,Ksp[Mg(OH)2]=1.8×10-11,加入CO(NH2)2至开始产生沉淀,溶液的pH=10,c(OH-)=![]() mol/L=10-4mol/L,Ksp[Mg(OH)2]= c(Mg2+)×c2(OH-)=1.8×10-11,则c(Mg2+)=1.8×10-3mol/L;
mol/L=10-4mol/L,Ksp[Mg(OH)2]= c(Mg2+)×c2(OH-)=1.8×10-11,则c(Mg2+)=1.8×10-3mol/L;
(5)图1为反应温度对纳米MgO产率和粒径的影响,据图分析50℃时氧化镁产率最大,反应的最佳温度为50℃;
(6)该原电池中,镁作负极,石墨作正极,正极上双氧水得电子生成氢氧根离子,电极反应式为H2O2+2e-=2OH-。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某实验小组模拟光合作用,采用电解CO2和H2O的方法制备CH3CH2OH和O2装置如图所示。下列说法不正确的是

A. 铂极为阳极,发生氧化反应
B. 电解过程中,H+由交换膜左侧向右侧迁移
C. 阴极的电极反应式为2CO2+12H++12e-====CH3CH2OH+3H2O
D. 电路上转移2mol电子时铂极产生11.2LO2(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以碳素铬铁为原料制取铬铵矾,利用电解法制取金属铬。其工艺流程如下图所示。
已知:H2SO4+Cr=CrSO4+H2↑
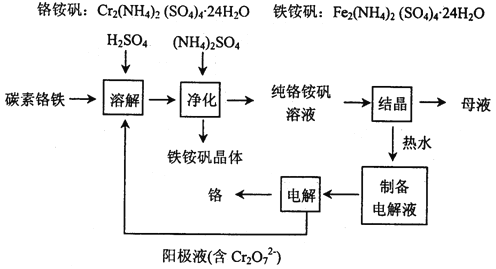
(1)碳素铬铁是铁铬合金,粉碎后溶于硫酸和电解阳极液的混合溶液中。该过程中电解阳极液的主要作用是_____________。
(2)加入(NH4)2SO4的目的是__________________。
(3)结晶后的母液从绿色化学的角度可采用的处理方法是__________________。
(4)产品铬中含氧呈脆性,为了降低其含氧量,可通过_____提高其纯度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中常用二氧化锰和浓盐酸反应来制备氯气,实验装置如图所示。
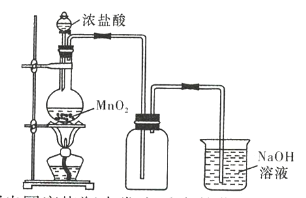
(1)写出圆底烧瓶中发生反应的化学方程式:___________________。
(2)若将过量的二氧化锰与20mL 12mol/L的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol,请写出两个可能的原因:①______________________________;②______________________________。
(3)为了提高浓盐酸的利用率,请写出两条改进措施:①______________________________;②______________________________。
(4)实验结束清洗仪器时,为了减小烧瓶中残留氯气对环境的污染,可以向烧瓶中加入 _____________ ,所发生反应的离子方程式 _________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是 ( )
A.0.1 mol·L-1 FeSO4溶液:Na+、K+、Cl-、![]()
B.滴入酚酞变红色的溶液:K+、Ca2+、![]() 、
、![]()
C.加入铁粉放出氢气的溶液:![]() 、Fe3+、ClO-、
、Fe3+、ClO-、![]()
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、![]() 、S2-、Cl-
、S2-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A、B、C是实验室常用的三种气体发生装置,现有药品:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰。欲利用这些药品制取NH3、Cl2、H2、CO2四种气体,试回答下列问题。
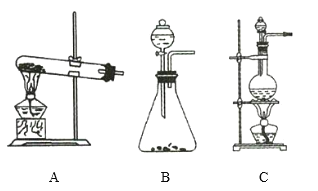
(1)①写出制取氨气的化学方程式: _____________________ ,氨气可用 _____________________ 进行干燥。
②制取![]() 的化学方程式为 _____________________ ,制取
的化学方程式为 _____________________ ,制取![]() 应选用装置 _____________________ (填序号)。
应选用装置 _____________________ (填序号)。
(2)①制取![]() 应选用装置 _____________________ (填序号)。
应选用装置 _____________________ (填序号)。
②生成的氯气先通过盛有 _____________________ 的洗气瓶,除去 _____________________ 气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是 ( )
A.钠与水反应:Na +2H2O![]() Na++2OH– + H2↑
Na++2OH– + H2↑
B.将铜插入稀硝酸中:Cu+4H++2NO3–===Cu2++2NO2↑+H2O
C.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH4+
D.向氢氧化钡溶液中加入稀硫酸:Ba2++OH– + H+ + ![]()
![]() BaSO4↓+H2O
BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2 FeO4在水中不稳定,发生反应:![]() +l0H2O
+l0H2O![]() 4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。下列说法不正确的是 ( )
4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。下列说法不正确的是 ( )
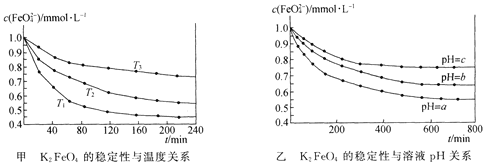
A.由图甲可知上述反应 △H < 0
B.由图甲可知温度:T1 > T2 > T3
C.由图甲可知K2 FeO4的稳定性随温度的升高而减弱
D.由图乙可知图中a < c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素的核内质子数之和为56,在元素周期表中的位置如图所示,1 mol E的单质可与足量酸反应,能产生33.6 L H2(在标准状况下);E的阳离子与A的阴离子核外电子层结构相同。
A | ||
B | C | D |
回答下列问题:
(1)写出下列元素名称A__________,B___________,E____________
(2)C的简单离子结构示意图为_____________
(3)B单质在A单质中燃烧,反应现象是__________________________________,生成物的化学式为___________
(4)A与E形成的化合物的化学式为__________,它的性质决定了它在物质的分类中应属于__________________
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液至过量,此过程中观察到的现象是_______________________,写出有关化学反应方程式______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com