
【题目】在实验室中常用二氧化锰和浓盐酸反应来制备氯气,实验装置如图所示。
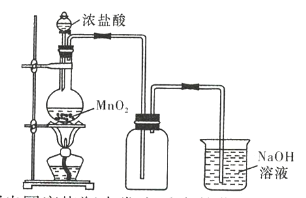
(1)写出圆底烧瓶中发生反应的化学方程式:___________________。
(2)若将过量的二氧化锰与20mL 12mol/L的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol,请写出两个可能的原因:①______________________________;②______________________________。
(3)为了提高浓盐酸的利用率,请写出两条改进措施:①______________________________;②______________________________。
(4)实验结束清洗仪器时,为了减小烧瓶中残留氯气对环境的污染,可以向烧瓶中加入 _____________ ,所发生反应的离子方程式 _________________________________ 。
【答案】![]() 加热导致大量
加热导致大量![]() 挥发 随着反应的进行,浓盐酸变为稀盐酸 使浓盐酸缓缓滴下 加热时用小火慢慢加热 NaOH溶液
挥发 随着反应的进行,浓盐酸变为稀盐酸 使浓盐酸缓缓滴下 加热时用小火慢慢加热 NaOH溶液 ![]()
【解析】
实验室中利用浓盐酸和二氧化锰固体共热制取氯气,氯气的密度比空气大可用向上排空气法收集,且氯气有毒尾气需要处理;反应过程中浓盐酸会变成稀盐酸从而停止与二氧化锰反应。
(1)圆底烧瓶中为生成氯气的反应,方程式为:![]() ;
;
(2)二氧化锰只与浓盐酸反应,反应过程中消耗氯化氢,同时加热导致大量氯化氢挥发,导致盐酸浓度降低变为稀盐酸,不再与二氧化锰反应;
(3)根据(2)可知浓盐酸的利用低的原因,所以改进措施为:使浓盐酸缓慢滴下,同时加热时用小火慢慢加热;
(4)氢氧化钠溶液可以吸收氯气,离子方程式为:![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】碳族元素包括碳、硅、锗![]() 、锡
、锡![]() 、铅等,它们的单质及化合物广泛应用于我们生活的各个领域。锗和锡曾被用于半导体材料,铅被用来制造蓄电池。碳族元素在化合物中只有铅以低价形式存在时较稳定,其他元素在化合物中都是以高价形式存在比较稳定。
、铅等,它们的单质及化合物广泛应用于我们生活的各个领域。锗和锡曾被用于半导体材料,铅被用来制造蓄电池。碳族元素在化合物中只有铅以低价形式存在时较稳定,其他元素在化合物中都是以高价形式存在比较稳定。
请回答下列问题:
(1)实验室用单质锡粉制取少量二氯化锡溶液,制取和保存的方法是![]() 用文字叙述
用文字叙述![]() ________。
________。
(2)铅有多种氧化物,写出四氧化三铅与浓盐酸反应的离子方程式:________。
(3)二氧化铅在空气中加强热会得到一系列铅的其他氧化物。若把![]() 二氧化铅加强热,当固体的质量变为
二氧化铅加强热,当固体的质量变为![]() 时,写出反应的化学方程式:________。
时,写出反应的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯盐可导致混凝土中的钢筋腐蚀。为防止混凝土中的钢筋腐蚀,可在混凝土表面敷置一定电解质溶液并将惰性金属导电网浸泡其中,惰性金属导电网与钢筋分别连接外部直流电源从而除去Cl-,装置如图,下列说法错误的是

A. 钢筋接电源的正极
B. 金属导电网上发生的电极反应为2Cl—2e-=Cl2↑
C. 混凝土中的钙离子向钢筋方向移动
D. 电解一段时间后钢筋附近溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,ΔH能正确表示物质的燃烧热的是
A.C(s)+![]() O2(g)===CO(g) ΔH=-110.5kJ·mol-1
O2(g)===CO(g) ΔH=-110.5kJ·mol-1
B.CO(g)+![]() O2(g)===CO2(g) ΔH=-283.0kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0kJ·mol-1
C.H2(g)+![]() O2(g)===H2O(g) ΔH=-241.8kJ·mol-1
O2(g)===H2O(g) ΔH=-241.8kJ·mol-1
D.2C8H18(l)+25O2(g)===16CO2(g)+18H2O(l) ΔH=-11036kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图10 的是
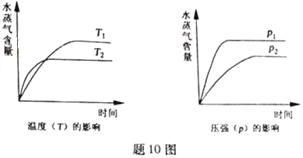
A. CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g);△H<0
CO(NH2)2(s)+H2O(g);△H<0
B. CO2(g)+H2(g)![]() CO(g)+H2O(g);△H>0
CO(g)+H2O(g);△H>0
C. CH3CH2OH (g)![]() CH2=CH2(g)+H2O(g);△H>0
CH2=CH2(g)+H2O(g);△H>0
D. 2C6H5CH2CH3(g)+O2(g)![]() 2 C6H5CH=CH2(g)+2H2O(g);△H<0
2 C6H5CH=CH2(g)+2H2O(g);△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种无机矿物盐![]() 仅含四种元素
仅含四种元素![]() 的组成和性质,设计并完成了如下实验:
的组成和性质,设计并完成了如下实验: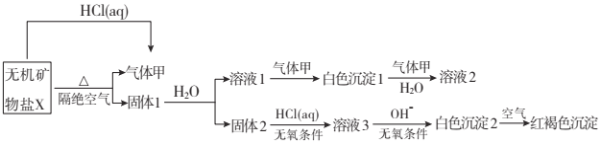
另取![]() 在惰性气流中加热至完全分解,得到
在惰性气流中加热至完全分解,得到![]() 固体1。请回答如下问题:
固体1。请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图__________,写出气体甲的电子式 __________。
(2)![]() 的化学式是__________,在惰性气流中加热X至完全分解的化学反应方程式为__________.
的化学式是__________,在惰性气流中加热X至完全分解的化学反应方程式为__________.
(3)白色沉淀2在空气中变成红褐色沉淀的原因是__________![]() 用化学反应方程式表示
用化学反应方程式表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁及其化合物有广泛用途。工业上以菱镁矿(主要成分为MgCO3,含SiO2以及少量FeCO3等杂质)为原料制备纳米氧化镁的实验流程如下:
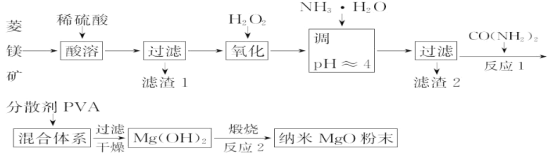
(1)加入H2O2氧化时,发生反应的离子方程式为___。
(2)在实验室煅烧滤渣2制得的金属氧化物为___(填化学式),需要的仪器除酒精灯、三脚架以外,还需要___(填序号)。
①蒸发皿 ②坩埚 ③泥三角 ④石棉网
(3)在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,反应的化学方程式为___。
(4)25℃时,加入CO(NH2)2至开始产生沉淀,溶液的pH=10时,c(Mg2+)=___molL-1(已知25℃,Ksp[Mg(OH)2]=1.8×10-11)。
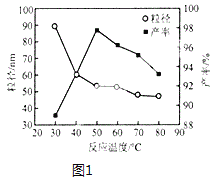
(5)工业上还可用氯化镁和碳酸铵为原料,采用直接沉淀法制备纳米MgO。如图1为反应温度对纳米MgO产率和粒径的影响,据图分析反应的最佳温度为___。
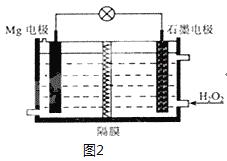
(6)Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图2如。该电池工作时,石墨电极发生的电极反应为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
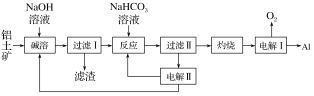
①“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是_______________。
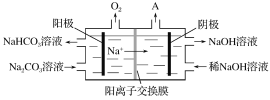
②“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为___________,阴极产生的物质A的化学式为________。
(2)与常规方法不同,有研究者用HCl—CuCl2做蚀刻液。蚀铜结束,会产生大量含Cu+废液,采用如图所示方法,可达到蚀刻液再生,回收金属铜的目的。此法采用掺硼的人造钻石BDD电极,可直接从水中形成一种具有强氧化性的氢氧自由基(HO·),请写出BDD电极上的电极反应________,进一步反应可实现蚀刻液再生,请写出刻蚀液再生的离子方程式__________。
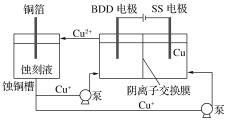
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子)。
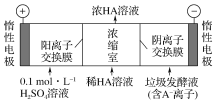
①阳极的电极反应式为____________。
②简述浓缩室中得到浓乳酸的原理:__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列短周期元素的数据(已知Be的原子半径为0.089nm):
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径 (nm) | 0.074 | 0.160 | 0.152 | 0.110 | 0.099 | 0.186 | 0.075 | 0.082 |
最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
最低负化合价 | 2 | 3 | 1 | 3 |
(1)⑧号元素的在周期表中的位置是________________;上述元素处于同一主族的有_________________。(用元素符号表示)
(2)上表中某两种元素形成的共价化合物中,每个原子都满足最外层为8电子的稳定结构,写出其电子式:_________________________(任写一种)。
(3)元素①和⑥能形成两种化合物,写出其中较稳定的化合物与水反应的离子方程式_____________________________________________________。
(4)含锂材料在社会中广泛应用,如各种储氢材料(Li2NH等)、便携式电源材料(LiCoO2等)。根据下列要求回答问题:
![]() 和
和![]() 作核反应堆最佳热载体,
作核反应堆最佳热载体,![]() 和
和![]() 用作高温堆减速剂。下列说法正确的是________。
用作高温堆减速剂。下列说法正确的是________。
A.![]() 和
和![]() 互为同位素B.
互为同位素B.![]() 和
和![]() 属于同种核素
属于同种核素
C.![]() 和
和![]() 的化学性质不同D.
的化学性质不同D.![]() 和
和![]() 是同种物质
是同种物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com