
����Ŀ���������ж�����Ԫ�ص�����(��֪Be��ԭ�Ӱ뾶Ϊ0.089nm)��
�� | �� | �� | �� | �� | �� | �� | �� | |
ԭ�Ӱ뾶 (nm) | 0.074 | 0.160 | 0.152 | 0.110 | 0.099 | 0.186 | 0.075 | 0.082 |
��������ϼ� | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
������ϼ� | 2 | 3 | 1 | 3 |
(1)���Ԫ�ص������ڱ��е�λ����________________������Ԫ�ش���ͬһ�������_________________��(��Ԫ�ط��ű�ʾ)
(2)�ϱ���ij����Ԫ���γɵĹ��ۻ������У�ÿ��ԭ�Ӷ����������Ϊ8���ӵ��ȶ��ṹ��д�������ʽ��_________________________(��дһ��)��
(3)Ԫ�آٺ͢����γ����ֻ����д�����н��ȶ��Ļ�������ˮ��Ӧ�����ӷ���ʽ_____________________________________________________��
(4)��﮲���������й㷺Ӧ�ã�����ִ������(Li2NH��)����Яʽ��Դ����(LiCoO2��)����������Ҫ��ش����⣺
![]() ��
��![]() ���˷�Ӧ����������壬
���˷�Ӧ����������壬![]() ��
��![]() �������¶Ѽ��ټ�������˵����ȷ����________��
�������¶Ѽ��ټ�������˵����ȷ����________��
A��![]() ��
��![]() ��Ϊͬλ��B��
��Ϊͬλ��B��![]() ��
��![]() ����ͬ�ֺ���
����ͬ�ֺ���
C��![]() ��
��![]() �Ļ�ѧ���ʲ�ͬD��
�Ļ�ѧ���ʲ�ͬD��![]() ��
��![]() ��ͬ������
��ͬ������
���𰸡��ڶ����ڵ���A�� Li��Na��N��P 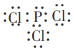 2Na2O2+2H2O=4Na++4OH+O2�� AD
2Na2O2+2H2O=4Na++4OH+O2�� AD
��������
Ԫ�آ������Ϊ-2�ۣ��Ұ뾶��Beԭ��С����ΪOԪ�أ�Ԫ�آ��������Ϊ+2�ۣ�ӦΪ��IIA��Ԫ�أ��뾶��Be������ΪMgԪ�أ��ۺ͢�������۾�Ϊ+1�ۣ�Ϊ��IA��Ԫ�أ��İ뾶���ڢۣ����ΪLi����ΪNaԪ�أ��ܺ͢߾�Ϊ����A��Ԫ�أ��ܰ뾶�ϴ����ΪP����ΪN����ΪCl������������Ϊ+3�ۣ�ӦΪ��IIIA��Ԫ�أ���뾶��BeС����ΪB��
(1)���Ԫ��ΪB�������ڱ��е�λ���ǵڶ����ڵ���A�壻����Ԫ�ش���ͬһ�������Li��Na��N��P��
(2)�ϱ���ij����Ԫ���γɵĹ��ۻ������У�ÿ��ԭ�Ӷ����������Ϊ8���ӵ��ȶ��ṹ����PCl3�������ʽΪ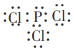 (��NCl3��Cl2O��)��
(��NCl3��Cl2O��)��
(3)Ԫ�آٺ͢����γ����ֻ����Na2O��Na2O2�����н��ȶ��Ļ�����Ϊ�������ƣ���ˮ��Ӧ�����ӷ���ʽΪ2Na2O2+2H2O=4Na++4OH+O2����
(4)A����������ͬ����������ͬ��ԭ�ӻ�Ϊͬλ�أ���![]() ��
��![]() ��Ϊͬλ�أ�A��ȷ��
��Ϊͬλ�أ�A��ȷ��
B��![]() ��
��![]() �������ֱ�Ϊ3��4�����ڲ�ͬ���أ�B����
�������ֱ�Ϊ3��4�����ڲ�ͬ���أ�B����
C��![]() ��
��![]() ��������Ԫ�غ��Ԫ����ɵ���ͬ�������ѧ������ͬ��C����
��������Ԫ�غ��Ԫ����ɵ���ͬ�������ѧ������ͬ��C����
D��![]() ��
��![]() ������Ԫ�غ��Ԫ����ɵ�ͬ�����ʣ�D��ȷ��
������Ԫ�غ��Ԫ����ɵ�ͬ�����ʣ�D��ȷ��
������ȷ��ΪAD��


 ȫ�ܲ����ĩС״Ԫϵ�д�
ȫ�ܲ����ĩС״Ԫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʵ�����г��ö������̺�Ũ���ᷴӦ���Ʊ�������ʵ��װ����ͼ��ʾ��
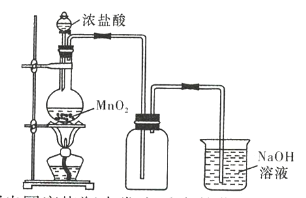
(1)д��Բ����ƿ�з�����Ӧ�Ļ�ѧ����ʽ��___________________��
(2)���������Ķ���������20mL 12mol/L�������ϼ��ȣ���ַ�Ӧ�����ɵ�������������0.06mol����д���������ܵ�ԭ��______________________________����______________________________��
(3)Ϊ�����Ũ����������ʣ���д�������Ľ���ʩ����______________________________����______________________________��
(4)ʵ�������ϴ����ʱ��Ϊ�˼�С��ƿ�в��������Ի�������Ⱦ����������ƿ�м��� _____________ ����������Ӧ�����ӷ���ʽ _________________________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��K2 FeO4��ˮ�в��ȶ���������Ӧ��![]() ��l0H2O
��l0H2O![]() 4Fe(OH)3�����壩��8OH����3O2�����ȶ������¶�(T)����ҺpH�Ĺ�ϵ�ֱ�����ͼ��ʾ������˵������ȷ���� ( )
4Fe(OH)3�����壩��8OH����3O2�����ȶ������¶�(T)����ҺpH�Ĺ�ϵ�ֱ�����ͼ��ʾ������˵������ȷ���� ( )
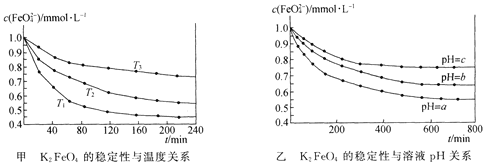
A.��ͼ��֪������Ӧ ��H < 0
B.��ͼ��֪�¶ȣ�T1 > T2 > T3
C.��ͼ��֪K2 FeO4���ȶ������¶ȵ����߶�����
D.��ͼ�ҿ�֪ͼ��a < c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Զ������ѱ��渲��Cu2Al2O4Ϊ���������Խ�CO2 ��CH4ֱ��ת�������ᡣ�ڲ�ͬ�¶��´����Ĵ�Ч�������������������ͼ��ʾ������˵����ȷ����

A. ��ͼ��֪������������������¶����߶�����
B. 250-300��ʱ���¶����߶�������������ʽ��͵���Ҫԭ������Ϊ�����Ĵ�Ч�ʽ���
C. ��300-400��ɵã�����������ͬʱ�������Ĵ�Ч��Խ�ͣ��������������Խ��
D. ����ͼ���Ʋ⣬��ҵ������������Ӧ�Ʊ����������˵��¶�ӦΪ400�档
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���о����֣����ᷢ��������ԭ��Ӧʱ�������Ũ��Խϡ����Ӧ��ԭ�����е�Ԫ�صĻ��ϼ�Խ�͡�����һ���������ۺ����۵Ļ������һ������ϡ�������ַ�Ӧ����Ӧ������������ų����ڷ�Ӧ���������Һ����μ���![]() ��Һ������NaOH��Һ�����
��Һ������NaOH��Һ�����![]() ��������������ʵ���
��������������ʵ���![]() ��ϵ����ͼ��ʾ������˵������ȷ����
��ϵ����ͼ��ʾ������˵������ȷ���� ![]()
![]()
A.ϡ���������ۡ����۷�Ӧ���仹ԭ����Ϊ�����
B.c���Ӧ��Һ�����Ϊ![]()
C.b����a��IJ�ֵΪ![]()
D.��Ʒ�����ۺ����۵����ʵ���֮��Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
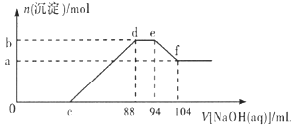
����Ŀ��K3[Fe(C2O4)3]�� 3H2O(�����������ؾ���)Ϊ����ɫ���壬 ����ˮ�� �������Ҵ��� 110����ʧȥ�ᾧˮ��230���ֽ⣻���Ʊ������ͻ�������������Ҫԭ�ϡ� ʵ��������(NH4)2Fe(SO4)2�� 6H2O (���������)��H2C2O4(����)��K2C2O4(�����)��30%˫��ˮ��Ϊԭ���Ʊ������������ؾ���IJ���ʵ��������£�
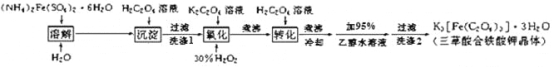
��֪������FeC2O4 �� 2H2O ��������ˮ��������ǿ��
6FeC2O4 + 3H2O2 + 6K2C2O4 = 4K3[Fe(C2O4)3] + 2Fe(OH)3��
2Fe(OH)3 + 3H2C2O4 + 3K2C2O4 = 2K3[Fe(C2O4)3] + 6H2O
��1����������������Ƿ���ʵ��Լ���_____���ܽ�ʱ�Ӽ���ϡ�����Ŀ����______��
��2�������������Һ�� H2C2O4��Һ��Ӧ���� FeC2O4 �� 2H2O ������д���÷�Ӧ����ʽ_______________���������˺�ϴ�� 1 �IJ���������_______________________________��
��3���ڳ����м��뱥�� K2C2O4 ��Һ������ 40 �� ����ˮԡ���ȣ��������������μ������� 30% H2O2��Һ�����Ͻ��衣�˹����豣���¶��� 40 �� ���ң����ܵ�ԭ����_______������30%����������Һ��ȫ��Ӧ����е�Ŀ����______________��
��4��ϴ�� 2 ������ϴ���Լ�����ʵ���_______����ѡ����ĸ����
A.��������Һ B.����ˮ C.�Ҵ� D.KCl��Һ
��5��Ϊ�˲��˷�ҩƷ��95%�Ҵ�ˮ��Һ���л��յķ�����________�����õ���Ҫ����������__________����д���֣��ȡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A��B��C��D��E���ֶ�����Ԫ�أ���֪A��B��C��D����Ԫ�صĺ���������֮��Ϊ56����Ԫ�����ڱ��е�λ����ͼ��ʾ��1 mol E�ĵ��ʿ��������ᷴӦ���ܲ���33.6 L H2(�ڱ�״����)��E����������A�������Ӻ�����Ӳ�ṹ��ͬ��
A | ||
B | C | D |
�ش��������⣺
��1��д������Ԫ������A__________��B___________��E____________
��2��C�ļ����ӽṹʾ��ͼΪ_____________
��3��B������A������ȼ�գ���Ӧ������__________________________________��������Ļ�ѧʽΪ___________
��4��A��E�γɵĻ�����Ļ�ѧʽΪ__________���������ʾ������������ʵķ�����Ӧ����__________________
��5����D��E�γɵĻ������ˮ��Һ�е����ռ���Һ���������˹����й۲쵽��������_______________________��д���йػ�ѧ��Ӧ����ʽ______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵������ȷ����
A.һ�������£��ϳɰ���Ӧ����0.5molN2������Ӧ����Ӧ��ת�Ƶ�����Ϊ3NA
B.10�˻�������2�������Ļ��Һ�У�̼Ԫ�ص���������Ϊ72%����������������ԭ����ĿΪ![]() NA
NA
C.12gʯī�к���3NA��C��C���ۼ�
D.���³�ѹ����28g�����辧�壬������������Si��Si����ĿΪ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(227��,1������ѹʱ)��1.5Lij����������aL��������ȫȼ�գ��������a+3��L����ͬ�����£����ʣ�
(1)����������ϱ�������Ļ���������____________________
(2)��a=10Lʱ���������ܵķ���ʽ__________________
(3)�������ķ���ʽΪC7H8ʱ��a��ȡֵ��ΧΪ____________________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com