
【题目】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入![]() 溶液,所加NaOH溶液的体积
溶液,所加NaOH溶液的体积![]() 与产生沉淀的物质的量
与产生沉淀的物质的量![]() 关系如下图所示,下列说法不正确的是
关系如下图所示,下列说法不正确的是 ![]()
![]()
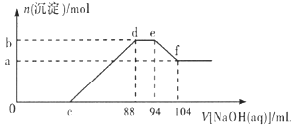
A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵
B.c点对应溶液的体积为![]()
C.b点与a点的差值为![]()
D.样品中铝粉和铁粉的物质的量之比为![]()
【答案】B
【解析】
铝粉和铁粉的混合物与一定量很稀![]() 充分反应,被氧化为
充分反应,被氧化为![]() 、
、![]() ,通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,又有硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由
,通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,又有硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由![]() 变成了
变成了![]() 价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可得与
价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可得与![]() 发生了反应,则随着NaOH的滴加,发生的反应依次有:
发生了反应,则随着NaOH的滴加,发生的反应依次有: ![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]() , b与a的差值为氢氧化铝的物质的量,由图可知,ef段消耗的氢氧化钠溶液为104mL-94mL=10mL,故该阶段参加反应的氢氧化钠为
, b与a的差值为氢氧化铝的物质的量,由图可知,ef段消耗的氢氧化钠溶液为104mL-94mL=10mL,故该阶段参加反应的氢氧化钠为![]() ,根据
,根据![]() 可知,
可知,![]() 的物质的量为
的物质的量为![]() ,根据铝元素守恒,故混合金属中
,根据铝元素守恒,故混合金属中![]() , 由图可知,de段消耗的氢氧化钠的体积为
, 由图可知,de段消耗的氢氧化钠的体积为![]() ,故该阶段参加反应的氢氧化钠为
,故该阶段参加反应的氢氧化钠为![]() ,根据
,根据![]() 可知,计算溶液中
可知,计算溶液中![]() ,根据电子转移守恒有,
,根据电子转移守恒有,![]() ,即
,即![]() ,解得
,解得![]() , 由反应过程可知,到加入氢氧化钠为88mL时,溶液中溶质为硝酸钠与硝酸铵,
, 由反应过程可知,到加入氢氧化钠为88mL时,溶液中溶质为硝酸钠与硝酸铵,![]() ,根据钠元素守恒,可知
,根据钠元素守恒,可知![]() ,根据氮元素守恒计算原硝酸溶液中
,根据氮元素守恒计算原硝酸溶液中![]() ,而c点溶液为
,而c点溶液为![]() 、
、![]() 、
、![]() 、
、![]() ,根据氮元素守恒
,根据氮元素守恒![]() ,故c点溶液中
,故c点溶液中![]() ,故c点加入NaOH的物质的量
,故c点加入NaOH的物质的量![]() ,据此解答;
,据此解答;
A.由上述分析可知,稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵,故A正确;
B.由上述分析可知,c点对应NaOH溶液的体积![]() ,故B错误;
,故B错误;
C.由上述分析可知,b与a的差值![]() ,故C正确;
,故C正确;
D.由上述分析可知,混合金属中![]() 、
、![]() ,样品中铝粉和铁粉的物质的量之比为5:3,故D正确;
,样品中铝粉和铁粉的物质的量之比为5:3,故D正确;
故答案为B。


科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图10 的是
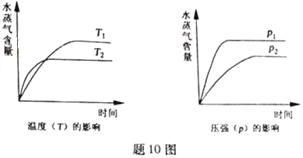
A. CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g);△H<0
CO(NH2)2(s)+H2O(g);△H<0
B. CO2(g)+H2(g)![]() CO(g)+H2O(g);△H>0
CO(g)+H2O(g);△H>0
C. CH3CH2OH (g)![]() CH2=CH2(g)+H2O(g);△H>0
CH2=CH2(g)+H2O(g);△H>0
D. 2C6H5CH2CH3(g)+O2(g)![]() 2 C6H5CH=CH2(g)+2H2O(g);△H<0
2 C6H5CH=CH2(g)+2H2O(g);△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是 ( )
A.Si与NaOH溶液反应:Si+2OH-+H2O===![]() +H2↑
+H2↑
B.向Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++![]() +OH-===CaCO3+H2O
+OH-===CaCO3+H2O
C.电解MgCl2溶液:2H2O+2Cl-![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
D.向含0.2 mol FeI2的溶液中滴加含0.25 mol Cl2的氯水:2Fe2++8I-+5Cl2===2Fe3++4I2+10Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在体积为2 L的密闭容器中,气态物质A、B、E、F的物质的量n随时间t的变化情况如图甲所示,在一定条件下反应达到平衡状态,反应进程中正反应速率随时间的变化情况如图乙所示,在t2、t4时刻分别只改变一个条件(温度、压强或某反应物的量)。下列说法错误的是( )

A. 此温度下,该反应的化学方程式为2A(g)+E(g)![]() 2B(g)+F(g)
2B(g)+F(g)
B. 若平衡状态①和②对应的温度相同,则①和②对应的平衡常数K一定相同
C. t2时刻改变的条件是增大压强
D. t4时刻改变的条件是降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年3月,我国科学家研发出一种新型的锌碘单液流电池,其原理如图所示。下列说法不正确的是

A. 放电时B电极反应式为:I2+2e-=2I-
B. 放电时电解质储罐中离子总浓度增大
C. M为阳离子交换膜,N为阴离子交换膜
D. 充电时,A极增重65g时,C区增加离子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列短周期元素的数据(已知Be的原子半径为0.089nm):
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径 (nm) | 0.074 | 0.160 | 0.152 | 0.110 | 0.099 | 0.186 | 0.075 | 0.082 |
最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
最低负化合价 | 2 | 3 | 1 | 3 |
(1)⑧号元素的在周期表中的位置是________________;上述元素处于同一主族的有_________________。(用元素符号表示)
(2)上表中某两种元素形成的共价化合物中,每个原子都满足最外层为8电子的稳定结构,写出其电子式:_________________________(任写一种)。
(3)元素①和⑥能形成两种化合物,写出其中较稳定的化合物与水反应的离子方程式_____________________________________________________。
(4)含锂材料在社会中广泛应用,如各种储氢材料(Li2NH等)、便携式电源材料(LiCoO2等)。根据下列要求回答问题:
![]() 和
和![]() 作核反应堆最佳热载体,
作核反应堆最佳热载体,![]() 和
和![]() 用作高温堆减速剂。下列说法正确的是________。
用作高温堆减速剂。下列说法正确的是________。
A.![]() 和
和![]() 互为同位素B.
互为同位素B.![]() 和
和![]() 属于同种核素
属于同种核素
C.![]() 和
和![]() 的化学性质不同D.
的化学性质不同D.![]() 和
和![]() 是同种物质
是同种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量):

根据以上规律判断,下列结论正确的是( )
A.反应Ⅰ:ΔH>0,p2>p1B.反应Ⅱ:ΔH>0,T1>T2
C.反应Ⅲ:ΔH>0,T2>T1或ΔH<0,T2<T1D.反应Ⅳ:ΔH<0,T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:① 2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1;②4NO2(g)+2NaCl(s)
NaNO3(s)+ClNO(g) K1;②4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2;③2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g) K2;③2NO(g)+Cl2(g)![]() 2ClNO(g) K3,则K1、K2、K3之间的关系为K3=_______________(用K1和K2表示);
2ClNO(g) K3,则K1、K2、K3之间的关系为K3=_______________(用K1和K2表示);
(2)已知几种化学键的键能数据如下表:(亚硝酰氯的结构为Cl—N==O)
化学键 | N≡O | Cl-Cl | Cl-N | N==O |
键能/(kJ·mol-1) | 630 | 243 | a | 607 |
则2NO(g)+Cl2(g)![]() 2ClNO(g)的反应的 △H和a的关系为 △H = ___kJ·mol-1。
2ClNO(g)的反应的 △H和a的关系为 △H = ___kJ·mol-1。
(3)300℃时,2NO(g)+Cl2 (g)![]() 2ClNO(g)的正反应速率表达式为v正 = k·cn (ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为v正 = k·cn (ClNO),测得速率和浓度的关系如下表:
序号 | c(ClNO)/(mol·L-1) | v/(mol·L-1·s-l) |
① | 0. 30 | 3. 60×10-9 |
② | 0. 60 | 1. 44×10-8 |
③ | 0. 90 | 3. 24×10-8 |
n = ___;k = ____。
(4)若向绝热恒容密闭容器中充入物质的量之比为2 : 1的NO和Cl2进行反应2NO(g)+Cl2(g)![]() 2ClNO(g),能判断反应已达到化学平衡状态的是__(填标号)。
2ClNO(g),能判断反应已达到化学平衡状态的是__(填标号)。
a.容器中的压强不变 b.2v正(NO) = v逆(Cl2)c.气体的平均相对分子质量保持不变 d.该反应平衡常数保持不变e.NO和Cl2的体积比保持不变
(5)25℃时,向体积为2 L且带气压计的恒容密闭容器中通入0.08 mol NO和0.04 mol Cl2发生反应:2NO(g)+Cl2 (g)![]() 2ClNO(g)△H。
2ClNO(g)△H。
①若反应起始和平衡时温度相同,测得反应过程中压强(p)随时间(t)的变化如图甲曲线a所示,则 △H __(填“>”“<”或“不确定”)0;若其他条件相同,仅改变某一条件时,测得其压强(p)随时间(t)的变化如图甲曲线b所示,则改变的条件是______。
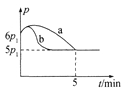
②图是甲、乙同学描绘上述反应平衡常数的对数值(lg K)与温度的变化关系,其中正确的曲线是____(填“甲”或“乙”),m值为_____。
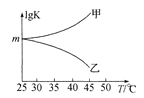
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
A.  B.
B.  C.
C. 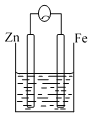
(1)A中反应的离子方程式为_____,B中Cu极电极反应式为______。
(2)C中被腐蚀的金属是____________,总反应方程式为____________,
(3)A、B、C中铁被腐蚀的速率,由大到小的顺序是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com