
【题目】下列热化学方程式中,ΔH能正确表示物质的燃烧热的是
A.C(s)+![]() O2(g)===CO(g) ΔH=-110.5kJ·mol-1
O2(g)===CO(g) ΔH=-110.5kJ·mol-1
B.CO(g)+![]() O2(g)===CO2(g) ΔH=-283.0kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0kJ·mol-1
C.H2(g)+![]() O2(g)===H2O(g) ΔH=-241.8kJ·mol-1
O2(g)===H2O(g) ΔH=-241.8kJ·mol-1
D.2C8H18(l)+25O2(g)===16CO2(g)+18H2O(l) ΔH=-11036kJ·mol-1
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和实验现象。请回答:
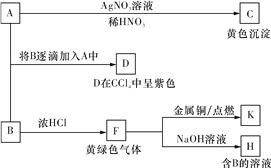
(1)写出C、D的化学式或分子式:__________、____________。
(2)指出D中所含元素在周期表中的位置________________,指出K的水溶液由稀到浓的颜色变化________________。
(3)将SO2气体通入D溶液,D溶液变为无色,生成两种强酸。写出该反应的化学方程式:________________________________________________________________________。
(4)F与粗硅加热生成__________(填分子式),该物质经蒸馏提纯后在1 100 ℃下与氢气反应生成高纯硅,写出后一步骤反应的化学方程式:_____________________________。
(5)0.25 mol F缓慢通入含有0.1 mol FeBr2、0.1 mol FeI2的混合溶液中,充分反应,试用一个离子方程式表示总反应:__________________________________________。
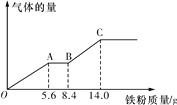
(6)某稀硫酸和稀硝酸的混合溶液100 mL,将其平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g铜粉;向另一份中逐渐加入铁粉,产生气体的量随铁粉质量的变化关系如图所示(假设硝酸的还原产物为NO气体)。则原混合溶液中NO3-的物质的量为__________,硫酸的物质的量浓度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、X均为中学化学常见的物质。它们之间存在如下图所示转化关系(图中反应条件略去)填写下列空白:
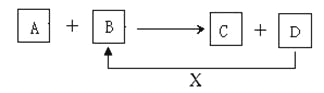
(1)若A为金属铝,B为氧化铁,写出反应A+B→C+D的一种用途______
(2)若A为两性氢氧化物, B为NaOH溶液,写出反应A+B→C+D的离子方程式________________。
(3)若A为金属单质,B、C、D都是化合物,A与B发生的反应常用于刻制印刷电路板,该反应的离子方程式________________________________________。
(4)若A、B、C为化合物,D、X为单质,A、B、C中肯定含有X元素的是________
查看答案和解析>>
科目:高中化学 来源: 题型:
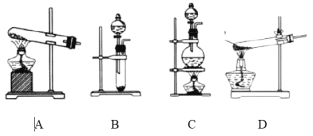
【题目】氯气是一种重要的化工原料,从氯气的发现到氯元素的确认,经历了数位科学家30多年的不懈探索,根据相关信息,回答下列问题:
(1)化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合并加热,很快产生有强烈刺激性气味的黄绿色气体,完成该反应的化学方程式:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+___。最合理的氯气发生装置是_______ (填字母)。
MnCl2+Cl2↑+___。最合理的氯气发生装置是_______ (填字母)。
(2)化学家贝托莱将Cl2的水溶液露置在阳光下,反应生成一种无色无味气体,该气体为_____。
(3)化学家泰耐特将Cl2通入石灰乳中,得到一种具有漂白作用的混合液。为证明该混合液的漂白作用,进行如下实验(试剂、材料等任选),完成下表中的空白。
实验步骤 | 实验现象 | 实验结论 |
取_____与试管中,滴加适量上述混合液,振荡 | ________ | 该混合液具有漂白作用 |
(4)我国学者近年研究了铜基催化剂作用下的反应:4HCl+O2![]() 2H2O+2Cl2,保持其他条件不变,温度为T1和T2时,HCl的反应速率v(HCl)随HCl的转化率
2H2O+2Cl2,保持其他条件不变,温度为T1和T2时,HCl的反应速率v(HCl)随HCl的转化率![]() (HCl)的变化示意图如下图所示,据图回答:
(HCl)的变化示意图如下图所示,据图回答:
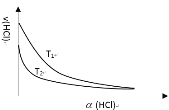
①T1____T2(填“>”、“<”、“=”);
②在同一温度下,![]() (HCl)越大,v(HCl)越_____(填“大”或“小”)。
(HCl)越大,v(HCl)越_____(填“大”或“小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以碳素铬铁为原料制取铬铵矾,利用电解法制取金属铬。其工艺流程如下图所示。
已知:H2SO4+Cr=CrSO4+H2↑
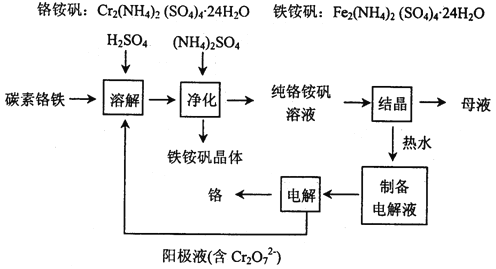
(1)碳素铬铁是铁铬合金,粉碎后溶于硫酸和电解阳极液的混合溶液中。该过程中电解阳极液的主要作用是_____________。
(2)加入(NH4)2SO4的目的是__________________。
(3)结晶后的母液从绿色化学的角度可采用的处理方法是__________________。
(4)产品铬中含氧呈脆性,为了降低其含氧量,可通过_____提高其纯度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叶蜡石的化学式为X2 [Y4 Z10](ZW)2,短周期元素W、Z、X、Y的原子序数依次增大,X与Y为同一周期相邻元素,Y的最外层电子数为次外层的一半,X的离子与ZW-含有相同的电子数。下列说法错误的是 ( )
A.X的最高价氧化物可作耐火材料
B.常温常压下,Z和W形成的常见化合物均为液体
C.原子半径:X > Y > Z > W
D.可用NaOH溶液分离X单质和Y单质的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中常用二氧化锰和浓盐酸反应来制备氯气,实验装置如图所示。
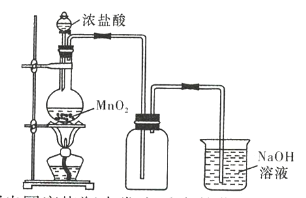
(1)写出圆底烧瓶中发生反应的化学方程式:___________________。
(2)若将过量的二氧化锰与20mL 12mol/L的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol,请写出两个可能的原因:①______________________________;②______________________________。
(3)为了提高浓盐酸的利用率,请写出两条改进措施:①______________________________;②______________________________。
(4)实验结束清洗仪器时,为了减小烧瓶中残留氯气对环境的污染,可以向烧瓶中加入 _____________ ,所发生反应的离子方程式 _________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A、B、C是实验室常用的三种气体发生装置,现有药品:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰。欲利用这些药品制取NH3、Cl2、H2、CO2四种气体,试回答下列问题。
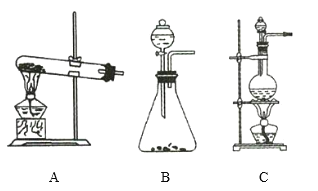
(1)①写出制取氨气的化学方程式: _____________________ ,氨气可用 _____________________ 进行干燥。
②制取![]() 的化学方程式为 _____________________ ,制取
的化学方程式为 _____________________ ,制取![]() 应选用装置 _____________________ (填序号)。
应选用装置 _____________________ (填序号)。
(2)①制取![]() 应选用装置 _____________________ (填序号)。
应选用装置 _____________________ (填序号)。
②生成的氯气先通过盛有 _____________________ 的洗气瓶,除去 _____________________ 气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2 和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示,下列说法正确的是

A. 由图可知:乙酸的生成速率随温度升高而升高
B. 250-300℃时,温度升高而乙酸的生成速率降低的主要原因是因为催化剂的催化效率降低
C. 由300-400℃可得,其他条件相同时,催化剂的催化效率越低,乙酸的生成速率越大。
D. 根据图像推测,工业上若用上述反应制备乙酸最适宜的温度应为400℃。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com