
【题目】A、B、C、D、X均为中学化学常见的物质。它们之间存在如下图所示转化关系(图中反应条件略去)填写下列空白:
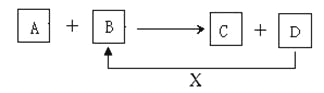
(1)若A为金属铝,B为氧化铁,写出反应A+B→C+D的一种用途______
(2)若A为两性氢氧化物, B为NaOH溶液,写出反应A+B→C+D的离子方程式________________。
(3)若A为金属单质,B、C、D都是化合物,A与B发生的反应常用于刻制印刷电路板,该反应的离子方程式________________________________________。
(4)若A、B、C为化合物,D、X为单质,A、B、C中肯定含有X元素的是________
【答案】焊接钢轨 Al(OH)3+OH﹣=AlO2﹣+2H2O Cu+2Fe3+═Cu2++2Fe2+ B、C
【解析】
(1)A为金属铝,B为氧化铁,考虑铝热反应,反应可以生成氧化铝与铁,铁与氧气反应生成Fe3O4,符合转化;
(2)A为两性氢氧化物,A为Al(OH)3,B为NaOH溶液,反应生成偏铝酸钠和水;
(3)A为金属单质,B、C、D都是化合物,A与B发生的反应常用于制作印刷电路板,则A为Cu,B含有Fe3+,B为FeCl3,反应生成Cu2+与Fe2+,Fe2+与Cl2反应生成FeCl3,符合转化;
(4)A、B、C为化合物,D、X为单质,由转化关系可知,单质D、X化合生成B,B中含有X元素,根据元素守恒可以,C中一定含有X元素。
(1)A为金属铝,B为氧化铁,发生铝热反应,生成氧化铝与铁,可以用来焊接钢轨,故答案为:焊接钢轨;
(2)A为两性氢氧化物,A为Al(OH)3,B为NaOH溶液,反应生成偏铝酸钠和水,反应离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)A为金属单质,B、C、D都是化合物,A与B发生的反应常用于制作印刷电路板,则A为Cu,B含有Fe3+,B为FeCl3,反应生成Cu2+与Fe2+,离子方程式为:Cu+2Fe3+═Cu2++2Fe2+,故答案为:Cu+2Fe3+═Cu2++2Fe2+;
(4)A、B、C为化合物,D、X为单质,由转化关系可知,单质D、X化合生成B,B中含有X元素,根据元素守恒可以,C中一定含有X元素,故答案为:B、C。


科目:高中化学 来源: 题型:
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:
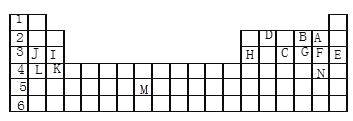
(1)表中用字母标出的14种元素中,化学性质最不活泼的是____(用元素符号表示,下同),金属性最强的是____,非金属性最强的是____,常温下单质为液态的非金属元素是____,属于过渡元素的是____(该空用字母表示)。
(2)B,F,C气态氢化物中最不稳定的是____。
(3)第三周期中原子半径最小的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳族元素包括碳、硅、锗![]() 、锡
、锡![]() 、铅等,它们的单质及化合物广泛应用于我们生活的各个领域。锗和锡曾被用于半导体材料,铅被用来制造蓄电池。碳族元素在化合物中只有铅以低价形式存在时较稳定,其他元素在化合物中都是以高价形式存在比较稳定。
、铅等,它们的单质及化合物广泛应用于我们生活的各个领域。锗和锡曾被用于半导体材料,铅被用来制造蓄电池。碳族元素在化合物中只有铅以低价形式存在时较稳定,其他元素在化合物中都是以高价形式存在比较稳定。
请回答下列问题:
(1)实验室用单质锡粉制取少量二氯化锡溶液,制取和保存的方法是![]() 用文字叙述
用文字叙述![]() ________。
________。
(2)铅有多种氧化物,写出四氧化三铅与浓盐酸反应的离子方程式:________。
(3)二氧化铅在空气中加强热会得到一系列铅的其他氧化物。若把![]() 二氧化铅加强热,当固体的质量变为
二氧化铅加强热,当固体的质量变为![]() 时,写出反应的化学方程式:________。
时,写出反应的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10L的密闭容器中充入1mol X和1mol Y进行反应:2X(g)+Y(g)![]() Z(g),60s后反应达到平衡,生成Z的物质的量为0.3mol。下列说法正确的是
Z(g),60s后反应达到平衡,生成Z的物质的量为0.3mol。下列说法正确的是
A.X的平衡转化率为40%
B.若将容器体积变为20L,则Z的平衡浓度小于原来的![]()
C.若增大压强,则Y的平衡转化率减小
D.若升高温度,X的体积分数增大,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定不同温度下0.5 mol·L-1 CuSO4溶液和0.5 mol·L-1 Na2CO3溶液pH,数据如下表:
温度/℃ | 25 | 30 | 40 | 50 | 60 |
CuSO4(aq) pH | 3.71 | 3.51 | 3.44 | 3.25 | 3.14 |
Na2CO3(aq) pH | 10.41 | 10.30 | 10.28 | 10.25 | 10.18 |
下列说法不正确的是
A. 升高温度,Na2CO3溶液中c(OH-)增大
B. 升高温度,CuSO4溶液和Na2CO3溶液的水解平衡均正向移动
C. 升高温度,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D. 升高温度,可能导致CO32-结合H+程度大于H2O电离产生H+程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图示,下列与此原理有关说法错误的是
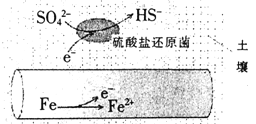
A. 正极反应为:SO42-+5H2O+8e-=HS-+9OH-
B. 输送暖气的管道不易发生此类腐蚀
C. 这种情况下,Fe腐蚀的最终产物为Fe2O3·xH2O
D. 管道上刷富锌油漆可以延缓管道的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯盐可导致混凝土中的钢筋腐蚀。为防止混凝土中的钢筋腐蚀,可在混凝土表面敷置一定电解质溶液并将惰性金属导电网浸泡其中,惰性金属导电网与钢筋分别连接外部直流电源从而除去Cl-,装置如图,下列说法错误的是

A. 钢筋接电源的正极
B. 金属导电网上发生的电极反应为2Cl—2e-=Cl2↑
C. 混凝土中的钙离子向钢筋方向移动
D. 电解一段时间后钢筋附近溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,ΔH能正确表示物质的燃烧热的是
A.C(s)+![]() O2(g)===CO(g) ΔH=-110.5kJ·mol-1
O2(g)===CO(g) ΔH=-110.5kJ·mol-1
B.CO(g)+![]() O2(g)===CO2(g) ΔH=-283.0kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0kJ·mol-1
C.H2(g)+![]() O2(g)===H2O(g) ΔH=-241.8kJ·mol-1
O2(g)===H2O(g) ΔH=-241.8kJ·mol-1
D.2C8H18(l)+25O2(g)===16CO2(g)+18H2O(l) ΔH=-11036kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
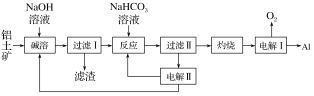
①“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是_______________。
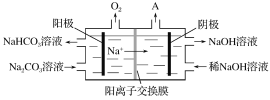
②“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为___________,阴极产生的物质A的化学式为________。
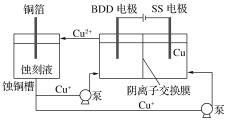
(2)与常规方法不同,有研究者用HCl—CuCl2做蚀刻液。蚀铜结束,会产生大量含Cu+废液,采用如图所示方法,可达到蚀刻液再生,回收金属铜的目的。此法采用掺硼的人造钻石BDD电极,可直接从水中形成一种具有强氧化性的氢氧自由基(HO·),请写出BDD电极上的电极反应________,进一步反应可实现蚀刻液再生,请写出刻蚀液再生的离子方程式__________。
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子)。
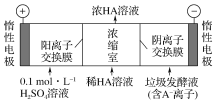
①阳极的电极反应式为____________。
②简述浓缩室中得到浓乳酸的原理:__________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com