
【题目】I.以下是元素周期表的一部分,根据图示回答下列问题:
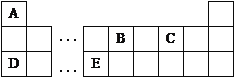
(1)将16.25gFeCl3投入足量A2C2溶液中,产生大量气泡,反应完全后,FeCl3的质量为__________g。
(2)1.3gB2A2气体完全燃烧,恢复至室温,放出65kJ热量,写出代表B2A2燃烧热的热化学反应方程式_____________________________________________________________。
(3)D的最高价氧化物的水化物与E的最高价氧化物的水化物反应的离子方程式为:
_____________________________________________________________。
II.X、Y、Z、W四种元素是周期表前四周期元素,X原子的核外有16种不同运动状态的电子,Y的原子序数比X大1,Z原子的外围电子排布式为3d64s2,W的价层电子排布式为ndn+5(n+1)sn-1。
(4)X在元素周期表中的位置___________________________;W元素的名称为_________。
(5)XY2分子中各原子均满足8电子稳定结构,画出XY2的电子式____________。
(6)电负性X_______Y;Z的原子结构示意图为____________________。
【答案】(1)16.25
(2)C2H2(g)+5/2O2(g) = 2CO2(g)+H2O(l) ΔH=-1300kJ/mol
(3) Al(OH)3+OH- = AlO2-+2H2O[或Al(OH)3+OH- = Al(OH)4-]
(4)第三周期ⅥA族; 镍
(5)![]()
(6)<;![]()
【解析】试题分析:根据元素周期表A、B、C、D、E分别是H、C、O、Na、Al。
(1)将16.25gFeCl3投入足量H2O2溶液中,产生大量气泡,FeCl3只起催化作用,反应完全后,FeCl3的质量为16.25g。
(2)1.3gC2H2气体完全燃烧,恢复至室温,放出65kJ热量,1molC2H2气体完全燃烧放热1300kJ,代表 C2H2燃烧热的热化学反应方程式C2H2(g)+5/2O2(g) = 2CO2(g)+H2O(l) ΔH=-1300kJ/mol。
(3)氢氧化钠与氢氧化铝反应的离子方程式为:Al(OH)3+OH-= AlO2-+2H2O[或Al(OH)3+OH-= Al(OH)4-]。
II.X、Y、Z、W四种元素是周期表前四周期元素,X原子的核外有16种不同运动状态的电子,X是S元素;Y的原子序数比X大1,Y是Cl元素;Z原子的外围电子排布式为3d64s2,Z是Fe元素;W的价层电子排布式为ndn+5(n+1)sn-1,n=3,则W的价层电子排布式为3d84s2,W是Ni元素。
(4) S在元素周期表中的位置第三周期ⅥA族;Ni元素的名称为镍。
(5)SCl2XY2的电子式![]() 。
。
(6)电负性S<Cl;Fe的原子结构示意图为![]()


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】锂——铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电能,其中放电过程为2Li+Cu2O+H2O=Cu+2Li++2OH-,下列说法不正确的是
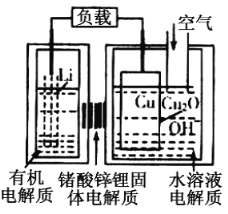
A.通空气时,铜被腐蚀,表面产生Cu2O
B.整个反应过程中,氧化剂为O2 ,Li为还原剂
C.放电时,Li+透过固体电解质向Cu极移动
D.放电时,正极的电极反应式为O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.糖类化合物都具有相同的官能团
B.糖类是提供能量最高的营养物质
C.蛋白质的水解产物都含有羧基和氨基
D.酯类在碱性条件下的水解反应称为皂化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y元素最高正价与最低负价的绝对值之差是4;Y元素与M元素形成离子化合物,并在水中电离出电子层结构相同的离子,该化合物是( )
A. KCl B. Na2S C. Na2O D. K2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g) ![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
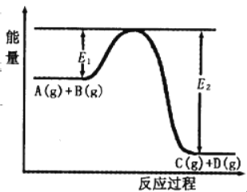
(1)该反应是______反应(填“吸热”“放热”);
(2)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1______,E2______(填“增大”“减小”、“不变”)。
(3)反应体系中加入催化剂对反应热是否有影响?______,(填“是”或“否”)原因是_______________。
(4)该反应的反应热△H=__________kJ/mol。(用E1和E2表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸是一种重要的化合物,其结构简式为:![]() 。在多种生物化学过程中乳酸起重要作用,在一般的新陈代谢和运动中乳酸不断被产生。请回答下列问题:
。在多种生物化学过程中乳酸起重要作用,在一般的新陈代谢和运动中乳酸不断被产生。请回答下列问题:
(1)用系统命名法命名乳酸___________________。
(2)乳酸发生消去反应所得产物的结构简式为______________________。
(3)1mol乳酸分别与足量的Na、Na2CO3、NaHCO3反应时,消耗三物质的物质的量之比为___________。
(4)乳酸在Cu或Ag作催化剂时会被氧气氧化,写出此反应的化学方程式:
____________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学方程式为___ ___。利用反应6NO2+8NH3=7N2+12H2O也可以处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是______L。
(2)已知:2SO2(g)+O2(g) ![]() 2SO3(g) △H= -196.6kJ/mol
2SO3(g) △H= -196.6kJ/mol
2NO(g)+O2(g) ![]() 2NO2(g) △H= -113.0kJ/mol
2NO2(g) △H= -113.0kJ/mol
则反应NO2(g)+SO2(g) =SO3(g)+NO(g)的△H=______kJ/mol。
(3)如下图所示,相同体积的a、b、c三密闭容器,其中c容器有一活塞,a、b两容器为定容容器,起始向三容器中都加入相同量的SO2和O2使三容器压强相等,一定条件下发生2SO2(g)+O2(g) ![]() 2SO3(g)的反应。问:
2SO3(g)的反应。问:
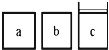
①起始a、c两容器的反应速率大小关系为Va_____Vc;(填“>”“<”或“=”下同)
②反应一段时间后a、c中速率大小关系为Va_____Vc;
③如起始在a、c两容器中通入等量的He,则此时三容器起始压强为Pa_____Pb_____Pc;起始反应速率关系为Va_____Vb_____Vc。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2、CO、NO都是常见的大气污染物。
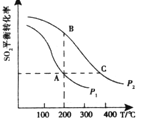
(1)工业上常用SO2除去CO,生成物为S和CO2。已知:S(s)+O2(g)=SO2(g) ![]() H=a kJmol-1
H=a kJmol-1
CO(g)+ ![]() O2(g)=CO2(g)
O2(g)=CO2(g) ![]() H=b kJmol-1则反应SO2(g)+2CO(g)=S(s)+2CO2(g)的
H=b kJmol-1则反应SO2(g)+2CO(g)=S(s)+2CO2(g)的![]() H= kJmol-1。
H= kJmol-1。
(2)在其他条件相同的密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g),分别测得SO2的平衡转化率在不同压强和温度下的变化曲线如右图所示。则:①A、B两点对应的反应速率:
2SO3(g),分别测得SO2的平衡转化率在不同压强和温度下的变化曲线如右图所示。则:①A、B两点对应的反应速率:![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
②B、C两点对应的化学平衡常数:![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(3)25℃时,用100mL0.1mol·L-1的NaOH溶液吸收SO2。当溶液中![]() 时,溶液显_______性(填“酸”、“中”或“碱”),溶液中
时,溶液显_______性(填“酸”、“中”或“碱”),溶液中![]() __________mol·L-1。(已知:H2SO3的电离平衡常数Kal=1×10-2mol·L-1,Ka2=2×10-7mol·L-1)
__________mol·L-1。(已知:H2SO3的电离平衡常数Kal=1×10-2mol·L-1,Ka2=2×10-7mol·L-1)
(4)电解NO2制备NH4NO3,其工作原理如下图所示。

①阳极电极反应式为________________________。
②为使电解产物全部转化为NH4NO3,需补充物质A,则A的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应。请根据装置回答下列问题:

(1)将铝片加入小试管内,然后注入足量的盐酸,有关反应的离子方程式是_____________________,试管中看到的现象是_______________________。
(2)弯管中A端液面________(填“上升”或“下降”),原因是_________________;说明此反应是________(填“放热”或“吸热”)反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com