
����Ŀ��SO2��CO��NO���dz����Ĵ�����Ⱦ�
��1����ҵ�ϳ���SO2��ȥCO��������ΪS��CO2����֪��S(s)+O2(g)=SO2(g) ![]() H=a kJmol-1
H=a kJmol-1
CO(g)+ ![]() O2(g)=CO2(g)
O2(g)=CO2(g) ![]() H=b kJmol-1��ӦSO2(g)+2CO(g)=S(s)+2CO2(g)��
H=b kJmol-1��ӦSO2(g)+2CO(g)=S(s)+2CO2(g)��![]() H= kJmol-1��
H= kJmol-1��
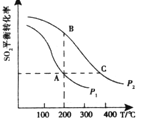
��2��������������ͬ���ܱ������з�����Ӧ��2SO2(g)+O2(g)![]() 2SO3(g)���ֱ���SO2��ƽ��ת�����ڲ�ͬѹǿ���¶��µı仯��������ͼ��ʾ����A��B�����Ӧ�ķ�Ӧ���ʣ�
2SO3(g)���ֱ���SO2��ƽ��ת�����ڲ�ͬѹǿ���¶��µı仯��������ͼ��ʾ����A��B�����Ӧ�ķ�Ӧ���ʣ�![]() (�>������<����=��)��
(�>������<����=��)��
��B��C�����Ӧ�Ļ�ѧƽ�ⳣ����![]() (�>������<����=��)��
(�>������<����=��)��
��3��25��ʱ����100mL0.1mol��L-1��NaOH��Һ����SO2������Һ��![]() ʱ����Һ��_______��(��ᡱ�����С��)����Һ��
ʱ����Һ��_______��(��ᡱ�����С��)����Һ��![]() __________mol��L-1��(��֪��H2SO3�ĵ���ƽ�ⳣ��Kal=1��10-2mol��L-1��Ka2=2��10-7mol��L-1)
__________mol��L-1��(��֪��H2SO3�ĵ���ƽ�ⳣ��Kal=1��10-2mol��L-1��Ka2=2��10-7mol��L-1)
��4�����NO2�Ʊ�NH4NO3���乤��ԭ������ͼ��ʾ��

�������缫��ӦʽΪ________________________��
��Ϊʹ������ȫ��ת��ΪNH4NO3���貹������A����A�Ļ�ѧʽΪ__________��
���𰸡���1��2b-a��2���� < �� >��3���� 0.02��4����NO2-e��+H2O =NO3-+2H�� ��NH3
��������
�����������1����֪����S(s)+O2(g)=SO2(g) ![]() H=a kJmol-1����CO(g)+
H=a kJmol-1����CO(g)+ ![]() O2(g)=CO2(g)
O2(g)=CO2(g) ![]() H=b kJmol-1�����ݸ�˹�����ڡ�2-���õ�����ӦSO2(g)+2CO(g)=S(s)+2CO2(g)��
H=b kJmol-1�����ݸ�˹�����ڡ�2-���õ�����ӦSO2(g)+2CO(g)=S(s)+2CO2(g)��![]() H=��2b-a��kJ/mol��
H=��2b-a��kJ/mol��
��2������ͼ�������֪AB���㣬�¶���ͬ�����������ת����A<B��˵��B��ѹǿ����A���ѹǿ��P1<P2�����Ӱ�췴Ӧ�������ط����жϣ�A�㷴Ӧ����С��B��ķ�Ӧ���ʡ�
��B��C��������ѹǿ��ͬ�����µ�ƽ�⣬�¶Ȳ�ͬƽ�ⳣ����ͬ��ͼ�������֪B���������ת���ʴ���C��ת���ʣ�˵������ƽ��������У���Ӧ�Ƿ��ȷ�Ӧ��B��ƽ�ⳣ������C�㡣
��3��������Һ�е���غ�����жϣ���Һ�д��ڵ���غ�c(H��)+c(Na��)=c(HSO3-)+2c(SO32-)+c(OH��)����Ϊc(Na��)=c(HSO3-)+2c(SO32-)��c(H��)=c(OH��)����Һ�����ԣ�����ƽ�ⳣ������������������ӵ�Ũ�ȣ�H2SO3�ĵ���ƽ�ⳣ��Ka1=1��10-2molL-1��H2SO3![]() HSO3-+H����c(Na��)=c(HSO3-)+2c(SO32-)= 0.1mol/L�٣�Ka2=[c(SO32-)��c(H��)]��c(HSO3-)=2��10-7��c(H��)=10-7mol/L�ڣ�����٢ڵõ�c(HSO3-)= 0.02mol/L��
HSO3-+H����c(Na��)=c(HSO3-)+2c(SO32-)= 0.1mol/L�٣�Ka2=[c(SO32-)��c(H��)]��c(HSO3-)=2��10-7��c(H��)=10-7mol/L�ڣ�����٢ڵõ�c(HSO3-)= 0.02mol/L��
��4�������ݹ���ԭ��ͼ��֪������NO2ʧ��������NO3-���������缫��ӦʽΪNO2-e��+H2O =NO3-+2H���������缫��ӦʽΪNO2+7e-+8H+=NH4++2H2O��������������ʧ���������ƽȻ����ӵõ������ܷ�Ӧ�Ļ�ѧ����ʽΪ8NO2+5H2O![]() NH4NO3+6HNO3���ӷ�Ӧ���Կ���������������NO3-�����ʵ�����������������NH4+�����ʵ���, ���Ҫʹ������ȫ��ת��ΪNH4NO3���貹��NH3 ��
NH4NO3+6HNO3���ӷ�Ӧ���Կ���������������NO3-�����ʵ�����������������NH4+�����ʵ���, ���Ҫʹ������ȫ��ת��ΪNH4NO3���貹��NH3 ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2006��6�£��ҹ�������2�κ쳱�¼�������ϴ�Ӽ���ʹ���йء�ͨ��ϴ�Ӽ��к�������������(Na5P3O10)��ϴ������ķ�ˮ��ֱ���ŷŵ��Ӻ��л����ˮ�ʸ�Ӫ��������ʹ���������ֳ����������������������ˮ�е����������ˮ��ȱ����ʹ��ˮ��ڱ���������ˮ��������ȱ����������
��1�����ⶨ֪��ij��������Ϊ����C 35.76%,��O 49.50%,��N 6.310%����H 7.370%,��P 0.870%,����������и�Ԫ��ԭ�Ӹ�����(���һ��Pԭ��) ________��
��2�����౻������ȫ�����Ļ�ѧ����ʽ(�����á���ѧʽ����ʾ���������O�ⶼΪ��ۻ�����)Ϊ_____________________________��
��3������һ�����Ϊ1��106 m2����20 m�ĺ�����������Ϊ9.1 g/m3,��ÿ������3%(��������)���������Ƶķ�ˮ1 000 kg,������������������ľ�(������е��������������ˮ��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I��������Ԫ�����ڱ���һ���֣�����ͼʾ�ش��������⣺
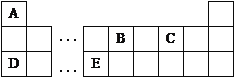
��1����16.25gFeCl3Ͷ������A2C2��Һ�У������������ݣ���Ӧ��ȫ��FeCl3������Ϊ__________g��
��2��1.3gB2A2������ȫȼ�գ��ָ������£��ų�65kJ������д������B2A2ȼ���ȵ��Ȼ�ѧ��Ӧ����ʽ_____________________________________________________________��
��3��D������������ˮ������E������������ˮ���ﷴӦ�����ӷ���ʽΪ��
_____________________________________________________________��
II��X��Y��Z��W����Ԫ�������ڱ�ǰ������Ԫ�أ�Xԭ�ӵĺ�����16�ֲ�ͬ�˶�״̬�ĵ��ӣ�Y��ԭ��������X��1��Zԭ�ӵ���Χ�����Ų�ʽΪ3d64s2��W�ļ۲�����Ų�ʽΪndn+5(n+1)sn-1��
��4��X��Ԫ�����ڱ��е�λ��___________________________��WԪ�ص�����Ϊ_________��
��5��XY2�����и�ԭ�Ӿ�����8�����ȶ��ṹ������XY2�ĵ���ʽ____________��
��6���縺��X_______Y��Z��ԭ�ӽṹʾ��ͼΪ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ��Br2+SO2+2H2O=2HBr+H2SO4��Ƚϣ�ˮ��������ԭ��Ӧ�е�����������ͬ����
A��CO+H2O=CO2+H2
B��4Fe��OH��2+O2+2H2O�T4Fe��OH��3
C��2F2+2H2O�T4HF+O2
D��2Al+2NaOH+2H2O�T2NaAlO2+3H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о������仯�����ת����ʵ�ʹ�ҵ�����������о�����Ҫ�����塣
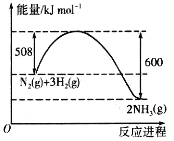
��1����֪![]()
![]()
![]() �������仯��ͼ��ʾ����һ���¶��£���2L�ĺ����ܱ�������Ͷ��2.2 molN2��2.6 mol H2����10 min�ﵽƽ�⣬��÷ų�������Ϊ18.4 kJ����
�������仯��ͼ��ʾ����һ���¶��£���2L�ĺ����ܱ�������Ͷ��2.2 molN2��2.6 mol H2����10 min�ﵽƽ�⣬��÷ų�������Ϊ18.4 kJ����![]() ______�����¶��£���Ӧ��ƽ�ⳣ��K=________(mol��L-1)-2��ƽ���������ϵ��Ͷ��1.1 mol N2��1.3 mol H2�����´ﵽƽ���N2���������________(�������С�����䡱)��
______�����¶��£���Ӧ��ƽ�ⳣ��K=________(mol��L-1)-2��ƽ���������ϵ��Ͷ��1.1 mol N2��1.3 mol H2�����´ﵽƽ���N2���������________(�������С�����䡱)��
��2�����ó��ȵĻ���̿���Դ���NO2����Ӧԭ��Ϊ![]()
![]()
![]() ��
��
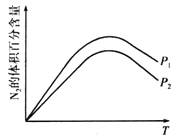
��̽���¶ȡ�ѹǿ�Ը÷�Ӧ��Ӱ����ͼ��ʾ����÷�Ӧ��![]() ___________0(�>����<����=��)��P1_____________P2(�>����<����=��)��
___________0(�>����<����=��)��P1_____________P2(�>����<����=��)��
��һ���¶��£���һ�����Ļ���̿��NO2����һ�����ܱ������У�����ʾ��ͼ��ȷ����˵����Ӧ�ﵽƽ��״̬����____________(�����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ������ ��
A�������Ƕ�����Դ B��ˮ���Ƕ�����Դ
C����Ȼ���Ƕ�����Դ D��ˮú����һ����Դ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ4A(s)��3B(g)===2C(g)��D(g)����2 min��B��Ũ�ȼ���0.6 mol��L��1������˵����ȷ����( )
A����A��ʾ�ķ�Ӧ������0.4 mol��L��1��min��1
B���ֱ���B��C��D��ʾ��Ӧ�����ʣ����ֵ��3��2��1
C����2 minĩ�ķ�Ӧ���ʣ���B��ʾ��0.3 mol��L��1��min��1
D������2 min��B��C������Ũ�ȶ�����С��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪijѧϰС����Ƶ���ȡ���������ĸĽ�װ��,��ʵ���������,��ش�������⡣
��1������ͼ��ʾ��װ��������,���Ƚ��еIJ����� ��
��2���ڴ��̶ȵ��Թ��м���һ��1%�ķ�̪��Һ�������ı���̼������Һ, ������̶�������̨�ϡ����ʱ���̼������Һ�������� ��
��3������ƿ�м����5 mL 37%�Ĵ��ᡢ��2 mL�ƾ��͢�2 mLŨ�����Լ�������ʯ�����ʼ�������Һ���˳���� (�������)�����뼸����ʯ�������� ��
��4��Բ����ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ�� ��
��5���Ѹ���ܴ������Ӵ�,ֹͣ����,���������,�ɿ����Թ��г������㲻ͬ��ɫ��Һ��,�ϲ�Һ�� ɫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ؾ�������ɱ�����ã��ṹ��ͼ��ʾ������������ȷ����
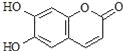
A. ��ϡH2SO4��ϼ��Ȳ���Ӧ
B. ����ʹ���Ը��������Һ��ɫ
C. 1mol �������������3mol Br2������Ӧ
D. 1mol��������������NaOH��Һ������Ӧʱ������NaOH 3mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com