
【题目】下列反应与Br2+SO2+2H2O=2HBr+H2SO4相比较,水在氧化还原反应中的作用与其相同的是
A.CO+H2O=CO2+H2
B.4Fe(OH)2+O2+2H2O═4Fe(OH)3
C.2F2+2H2O═4HF+O2
D.2Al+2NaOH+2H2O═2NaAlO2+3H2↑
科目:高中化学 来源: 题型:
【题目】将2.5 g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶于水,制成稀溶液,然后向该溶液中逐滴加入1 mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
(1) 写出OA段所发生反应的离子方程式_______________。
(2)当加入35 mL盐酸时,产生CO2的体积为___________mL(标准状况)。
(3)原混合物中NaOH的质量为___________g,碳酸钠的质量分数为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y元素最高正价与最低负价的绝对值之差是4;Y元素与M元素形成离子化合物,并在水中电离出电子层结构相同的离子,该化合物是( )
A. KCl B. Na2S C. Na2O D. K2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸是一种重要的化合物,其结构简式为:![]() 。在多种生物化学过程中乳酸起重要作用,在一般的新陈代谢和运动中乳酸不断被产生。请回答下列问题:
。在多种生物化学过程中乳酸起重要作用,在一般的新陈代谢和运动中乳酸不断被产生。请回答下列问题:
(1)用系统命名法命名乳酸___________________。
(2)乳酸发生消去反应所得产物的结构简式为______________________。
(3)1mol乳酸分别与足量的Na、Na2CO3、NaHCO3反应时,消耗三物质的物质的量之比为___________。
(4)乳酸在Cu或Ag作催化剂时会被氧气氧化,写出此反应的化学方程式:
____________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学方程式为___ ___。利用反应6NO2+8NH3=7N2+12H2O也可以处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是______L。
(2)已知:2SO2(g)+O2(g) ![]() 2SO3(g) △H= -196.6kJ/mol
2SO3(g) △H= -196.6kJ/mol
2NO(g)+O2(g) ![]() 2NO2(g) △H= -113.0kJ/mol
2NO2(g) △H= -113.0kJ/mol
则反应NO2(g)+SO2(g) =SO3(g)+NO(g)的△H=______kJ/mol。
(3)如下图所示,相同体积的a、b、c三密闭容器,其中c容器有一活塞,a、b两容器为定容容器,起始向三容器中都加入相同量的SO2和O2使三容器压强相等,一定条件下发生2SO2(g)+O2(g) ![]() 2SO3(g)的反应。问:
2SO3(g)的反应。问:
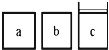
①起始a、c两容器的反应速率大小关系为Va_____Vc;(填“>”“<”或“=”下同)
②反应一段时间后a、c中速率大小关系为Va_____Vc;
③如起始在a、c两容器中通入等量的He,则此时三容器起始压强为Pa_____Pb_____Pc;起始反应速率关系为Va_____Vb_____Vc。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)苯、四氯化碳、乙醇、汽油是常见的有机溶剂,能与水互溶的是 ,不溶于水,且密度比水小的是 。
(2)写出下列反应的化学方程式并注明反应类型
① 用乙烷制备氯乙烷(C2H5Cl) , ;
② 乙烯与水反应制乙醇 , ;
③ 苯制取溴苯 , 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2、CO、NO都是常见的大气污染物。
(1)工业上常用SO2除去CO,生成物为S和CO2。已知:S(s)+O2(g)=SO2(g) ![]() H=a kJmol-1
H=a kJmol-1
CO(g)+ ![]() O2(g)=CO2(g)
O2(g)=CO2(g) ![]() H=b kJmol-1则反应SO2(g)+2CO(g)=S(s)+2CO2(g)的
H=b kJmol-1则反应SO2(g)+2CO(g)=S(s)+2CO2(g)的![]() H= kJmol-1。
H= kJmol-1。
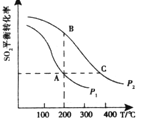
(2)在其他条件相同的密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g),分别测得SO2的平衡转化率在不同压强和温度下的变化曲线如右图所示。则:①A、B两点对应的反应速率:
2SO3(g),分别测得SO2的平衡转化率在不同压强和温度下的变化曲线如右图所示。则:①A、B两点对应的反应速率:![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
②B、C两点对应的化学平衡常数:![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(3)25℃时,用100mL0.1mol·L-1的NaOH溶液吸收SO2。当溶液中![]() 时,溶液显_______性(填“酸”、“中”或“碱”),溶液中
时,溶液显_______性(填“酸”、“中”或“碱”),溶液中![]() __________mol·L-1。(已知:H2SO3的电离平衡常数Kal=1×10-2mol·L-1,Ka2=2×10-7mol·L-1)
__________mol·L-1。(已知:H2SO3的电离平衡常数Kal=1×10-2mol·L-1,Ka2=2×10-7mol·L-1)
(4)电解NO2制备NH4NO3,其工作原理如下图所示。

①阳极电极反应式为________________________。
②为使电解产物全部转化为NH4NO3,需补充物质A,则A的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学键的下列叙述中,正确的是( )
A.离子化合物可能含共价键
B.共价化合物可能含离子键
C.离子化合物中只含离子键
D.共价化合物中可能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法不符合事实的是
A.SO2可用于杀菌、消毒 B.HF可用于雕刻玻璃
C.NH3可用于制硝酸 D.SiO2可用于制太阳能电池
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com