
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学方程式为___ ___。利用反应6NO2+8NH3=7N2+12H2O也可以处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是______L。
(2)已知:2SO2(g)+O2(g) ![]() 2SO3(g) △H= -196.6kJ/mol
2SO3(g) △H= -196.6kJ/mol
2NO(g)+O2(g) ![]() 2NO2(g) △H= -113.0kJ/mol
2NO2(g) △H= -113.0kJ/mol
则反应NO2(g)+SO2(g) =SO3(g)+NO(g)的△H=______kJ/mol。
(3)如下图所示,相同体积的a、b、c三密闭容器,其中c容器有一活塞,a、b两容器为定容容器,起始向三容器中都加入相同量的SO2和O2使三容器压强相等,一定条件下发生2SO2(g)+O2(g) ![]() 2SO3(g)的反应。问:
2SO3(g)的反应。问:
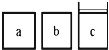
①起始a、c两容器的反应速率大小关系为Va_____Vc;(填“>”“<”或“=”下同)
②反应一段时间后a、c中速率大小关系为Va_____Vc;
③如起始在a、c两容器中通入等量的He,则此时三容器起始压强为Pa_____Pb_____Pc;起始反应速率关系为Va_____Vb_____Vc。
【答案】(12分)
(1)3NO2+H2O═2HNO3+NO;6.72;
(2)-41.8kJ/mol;
(3)①= ;②< ; ③> ;= ;= ;>。
【解析】
试题分析:(1)二氧化氮和水反应生成硝酸和一氧化氮,反应的化学方程式为:3NO2+H2O=2HNO3+NO,反应6NO2+8NH3![]() 7N2+12H2O中,6NO2中N元素化合价降低,由+4价降低到0价,则6mol NO2参加反应,转移24mol电子,所以当转移1.2mol电子时,消耗NO2 0.3mol,体积为V(NO2)= 0.3mol×22.4L/mol=6.72L;(2)已知:①2SO2(g)+O2(g)
7N2+12H2O中,6NO2中N元素化合价降低,由+4价降低到0价,则6mol NO2参加反应,转移24mol电子,所以当转移1.2mol电子时,消耗NO2 0.3mol,体积为V(NO2)= 0.3mol×22.4L/mol=6.72L;(2)已知:①2SO2(g)+O2(g) ![]() 2SO3(g) △H= -196.6kJ/mol,②2NO(g)+O2(g)
2SO3(g) △H= -196.6kJ/mol,②2NO(g)+O2(g) ![]() 2NO2(g) △H= -113.0kJ/mol,利用盖斯定律将(①-②)÷2,整理可得得NO2(g)+SO2(g) =SO3(g)+NO(g)=-41.8kJmol-1;(3)①起始时压强相等,则反应物的浓度相等,反应速率相等,故答案为Va=Vc:;②c为恒压,由于该反应的正反应是气体物质的量减小的反应,所以反应一段时间后,c中压强大于a,压强越大,物质的浓度就越大,反应速率就越快,因此反应一段时间后a、c中速率大小关系为Va<Vc;③如起始在a、c两容器中通入同量的He ,He不参加反应,c保持恒压,则体积应增大,则此时三容器起始压强为Pa =Pb>Pc ,反应速率Va =Vb ,由于c体积最大,浓度最小,则反应速率最小,三个容器中的气体反应速率关系是Va=Vb>Vc。
2NO2(g) △H= -113.0kJ/mol,利用盖斯定律将(①-②)÷2,整理可得得NO2(g)+SO2(g) =SO3(g)+NO(g)=-41.8kJmol-1;(3)①起始时压强相等,则反应物的浓度相等,反应速率相等,故答案为Va=Vc:;②c为恒压,由于该反应的正反应是气体物质的量减小的反应,所以反应一段时间后,c中压强大于a,压强越大,物质的浓度就越大,反应速率就越快,因此反应一段时间后a、c中速率大小关系为Va<Vc;③如起始在a、c两容器中通入同量的He ,He不参加反应,c保持恒压,则体积应增大,则此时三容器起始压强为Pa =Pb>Pc ,反应速率Va =Vb ,由于c体积最大,浓度最小,则反应速率最小,三个容器中的气体反应速率关系是Va=Vb>Vc。


科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列说法错误的是
A.AgCl不溶于水,不能转化为AgI
B.在含有浓度均为0.001 mol·L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀
C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI
D.常温下AgCl在NaI溶液中开始转化为AgI则NaI的浓度必须不低于![]() ×10-11 mol·L-1
×10-11 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机高分子化合物甲是一种常用的光敏高分子材料,其结构简式为:
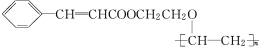
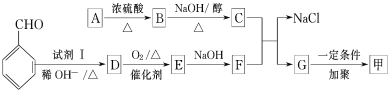
按下图流程可以合成甲,其中试剂Ⅰ可由相对分子质量为26的烃与水加成制得。
已知:
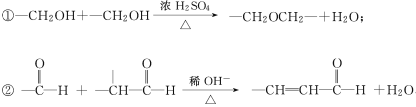
回答下列问题:
(1)质谱图显示A的相对分子质量是80.5。A分子中氧元素的质量分数为19.88%,碳元素的质量分数为29.81%,其余为氢元素和氯元素。A的核磁共振氢谱上有三个吸收峰,峰面积的比例为2∶2∶1。A的结构简式为 。
(2)试剂Ⅰ的名称是________________;B→C的反应类型是________________。
(3)写出下列反应的化学方程式:
①A→B:________________________;
②D→E:________________________;
③C与F的反应:________________________。
(4)E的一种同分异构体,水解产物有两种,一种能使溴水褪色,另一种在滴加饱和溴水后,有白色沉淀生成,该物质的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.以下是元素周期表的一部分,根据图示回答下列问题:
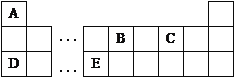
(1)将16.25gFeCl3投入足量A2C2溶液中,产生大量气泡,反应完全后,FeCl3的质量为__________g。
(2)1.3gB2A2气体完全燃烧,恢复至室温,放出65kJ热量,写出代表B2A2燃烧热的热化学反应方程式_____________________________________________________________。
(3)D的最高价氧化物的水化物与E的最高价氧化物的水化物反应的离子方程式为:
_____________________________________________________________。
II.X、Y、Z、W四种元素是周期表前四周期元素,X原子的核外有16种不同运动状态的电子,Y的原子序数比X大1,Z原子的外围电子排布式为3d64s2,W的价层电子排布式为ndn+5(n+1)sn-1。
(4)X在元素周期表中的位置___________________________;W元素的名称为_________。
(5)XY2分子中各原子均满足8电子稳定结构,画出XY2的电子式____________。
(6)电负性X_______Y;Z的原子结构示意图为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应与Br2+SO2+2H2O=2HBr+H2SO4相比较,水在氧化还原反应中的作用与其相同的是
A.CO+H2O=CO2+H2
B.4Fe(OH)2+O2+2H2O═4Fe(OH)3
C.2F2+2H2O═4HF+O2
D.2Al+2NaOH+2H2O═2NaAlO2+3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮及其化合物的转化在实际工业生产、生活中具有重要的意义。
(1)已知![]()
![]()
![]() 的能量变化如图所示,在一定温度下,向2L的恒容密闭容器中投入2.2 molN2和2.6 mol H2,经10 min达到平衡,测得放出的热量为18.4 kJ,则
的能量变化如图所示,在一定温度下,向2L的恒容密闭容器中投入2.2 molN2和2.6 mol H2,经10 min达到平衡,测得放出的热量为18.4 kJ,则![]() ______。该温度下,反应的平衡常数K=________(mol·L-1)-2。平衡后,再向体系中投入1.1 mol N2和1.3 mol H2,重新达到平衡后N2的体积分数________(填“增大”“减小”或“不变”)。
______。该温度下,反应的平衡常数K=________(mol·L-1)-2。平衡后,再向体系中投入1.1 mol N2和1.3 mol H2,重新达到平衡后N2的体积分数________(填“增大”“减小”或“不变”)。
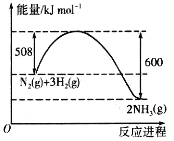
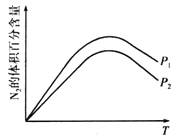
(2)利用炽热的活性炭可以处理NO2,反应原理为![]()
![]()
![]() 。
。
①探究温度、压强对该反应的影响如图所示,则该反应的![]() ___________0(填“>”“<”或“=”),P1_____________P2(填“>”“<”或“=”)。
___________0(填“>”“<”或“=”),P1_____________P2(填“>”“<”或“=”)。
②一定温度下,将一定量的活性炭和NO2加入一恒容密闭容器中,下列示意图正确且能说明反应达到平衡状态的是____________(填序号)。
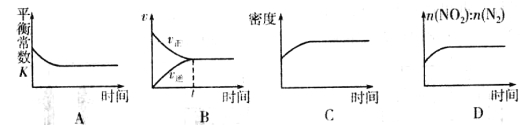
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)===2C(g)+D(g),经2 min,B的浓度减少0.6 mol·L-1。下列说法正确的是( )
A.用A表示的反应速率是0.4 mol·L-1·min-1
B.分别用B、C、D表示反应的速率,其比值是3∶2∶1
C.在2 min末的反应速率,用B表示是0.3 mol·L-1·min-1
D.在这2 min内B和C两物质浓度都是逐渐减小的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国市售加碘食盐中含有碘酸钾。已知碘酸钾在酸性条件下是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
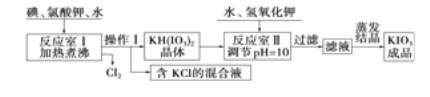
请回答下列问题:
(1)已知反应室Ⅰ发生的反应中,两种还原产物所得电子数相同,请写出该反应的化学方程式: 。
(2)反应室Ⅰ需加热煮沸,其目的是:①加快反应速率,使反应物充分反应:② (请从化学平衡角度解释)。
(3)已知几种物质的溶解度见下表:
KCl | KH(IO3)2 | KClO3 | |
溶解度g/100 g水(25 ℃) | 20.8 | 0.8 | 7.5 |
溶解度g/100 g水(80 ℃) | 37.1 | 12.4 | 16.2 |
由上表数据分析可知,操作Ⅰ的名称为 、 。
(4)在反应室Ⅱ中加入KOH调节溶液的pH=10,其目的是 。
(5)甲同学欲测定成品中碘酸钾的含量,设计了如下实验:
①准确称取1 g样品,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化上述所得溶液,加入过量KI溶液,充分搅拌;
③以淀粉为指示剂,逐滴加入2.0 mol·L-1的Na2S2O3溶液,当蓝色刚好褪去时,消耗Na2S2O3溶液12.00 mL,则成品中KIO3的质量分数为 (列式计算,结果保留三位有效数字)
(已知:KIO3+5KI+3H2SO4===3K2SO4+3I2+3H2O,I2+2Na2S2O3===2NaI+Na2S4O6)。
(6)乙同学又对纯净的NaCl(不含KIO3)进行了下列实验:
操作步骤 | 实验现象 |
取1g纯净的NaCl,加3mL水配成溶液。 | 溶液无变化 |
滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡。 | 溶液无变化 |
然后再滴入1滴1mol/L的H2SO4,振荡。 | 溶液变蓝色 |
①请推测实验中产生蓝色现象的可能原因,用离子方程式表示 。
②根据乙同学的实验结果推测,甲同学的实验结果会 (填“偏大”,“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com