
【题目】已知甲、乙、丙、丁是四种中学化学中常见的物质,其转化关系如图所示。则甲和丁不可能是
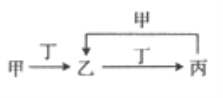
A. N2和O2 B. Cl2和Fe C. C和O2 D. SO2和NaOH溶液
【答案】A
【解析】A、若甲和丁为N2和O2,氮气和氧气在放电条件下反应生成一氧化氮,一氧化氮与氧气反应生成二氧化氮,但二氧化氮无法与氮气反应生成一氧化氮,转化关系错误;B、若甲和丁为Cl2和Fe,氯气和铁点燃反应生成氯化铁,氯化铁溶液与铁反应生成氯化亚铁,氯化亚铁溶液与氯气反应生成氯化铁,转化关系正确;C、若甲和丁为C和O2,氧气与碳反应生成二氧化碳,二氧化碳与碳在高温条件下反应生成一氧化碳,一氧化碳与氧气反应生成二氧化碳,转化关系正确;D、若甲和丁为SO2和NaOH溶液,二氧化硫与氢氧化钠反应生成亚硫酸钠,亚硫酸钠溶液与二氧化硫反应生成亚硫酸氢钠,亚硫酸氢钠与氢氧化钠反应生成亚硫酸钠和水,转化关系正确。答案选A。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】向偏铝酸钠溶液中逐滴加入盐酸,溶被的pH值随着加入盐酸体积的变化曲线如图所示,则下列说法正确的是
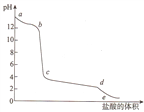
A. a~b段的主要离子方程式为A102-+4H+=Al3++2H2O
B. 向c点溶液中滴加氨水,发生的离子方程式为A13++30H-=Al(OH)3↓
C. c~d段的主要离子方程式为Al(OH)3+3H+= A13++3H2O
D. 向c点溶液中加入碳酸钠,发生的离子方程式为2 A13++CO32-+3H2O =2Al(OH)3↓+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选修3:物质结构与性质】铜元素可形成多种重要化合物。回答下列问题:
(1)铜元素位于元素周期表中的_____区,其基态原子的价电子排布图为_________。
(2)往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4溶液,该溶液可用于溶解纤维素。
①[Cu(NH3)4]SO4中阴离子的立体构型是__________。
②在[Cu(NH3)4]SO4中,Cu2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_________。
③除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为________。
④NF3与NH3的空间构型相同,中心原子的轨道杂化类型均为_________。但NF3不易与Cu2+形成化学键,其原因是_______________。
(3)一种Hg-Ba-Cu-O高温超导材料的晶胞(长方体)如图所示。

①该物质的化学式为__________。
②已知该晶胞中两个Ba2+的间距为cpm.则距离Ba2+最近的Hg+数目为_____个,二者的最短距离为_______pm。(列出计算式即可,下同)
③设该物质的摩尔质量为M,阿伏加德罗常数的值为NA,则该晶体的密度为______g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、C、N、C、Na、S、Fe是中学化学中常见的元素,请根据题意回答与这些元素有关的问题:
(1)Fe元素在元素周期表中的位置:___________________;
(2) 写出(CN)2的电子式: __________________;
(3)用电子式表示Na3N 的形成过程: __________________;
(4)各种氮氧化物(NO、NO2)是主要的大气污染物之一,治理氨氧化物(NOx)废气的方法之一是用NaOH溶液进行吸收,其反应原理可表示如下:
NO2 +NO+2NaOH=2NaNO2+H2O 2NO2 + 2NaOH =NaNO2+NaNO3+H2O
现有NO 与NO2的混合气体,将其通入50 mL 2 mol/L的NaOH 溶液中,恰好完全吸收,测得溶液中含有NO3-0.02 mol,混合气体中v(NO): v(NO2)=_________;
(5) 向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe3+、Fe2+等粒子物质的量随n(Cl2)/n(FeI2 )的变化可用下图简单表示
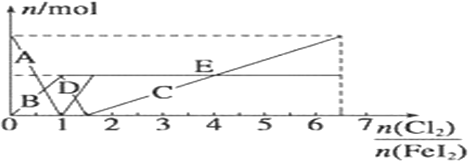
当n(Cl2)/n(FeI2 )=6.5 时,溶液中n(Cl-):n(IO3-)=_________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是大气污染物之一,为探究SO2气体的性质,某实验小组利用如图1所示装置进行实验。
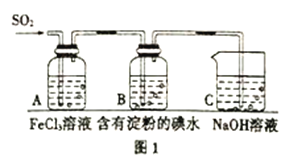
(1)装置A中发生反应的离子方程式为:______________;
(2)装置C的作用是:______________;
(3)在上述装置中通入过量的SO2,为了验证A 中SO2 与Fe3+发生了氧化还原反应,取A 中的溶液少 量,分成两份,并设计了如下实验方案:
方案①:向第一份溶液中加入少量酸性KMnO4溶液,发现紫红色褪去;
方案②,向第二份溶液中加入少量KSCN 溶液,发现不变红,再加入少量新制的氯水,深液变红;
上述方案中不合理的是:________,原因是: ________________;
(4)能表明I-的还原性弱于SO2 的现象是: ________________;
(5)设计实验验证反应结束后A 装置中的Cl-:________________;
(6) 该小组同学设计实验模报测定硫酸工业生产排放的尾气中SO2的体积分数(其他气体均难溶于水且不发生任何反应),选用了如图2所示的简易实验装置。
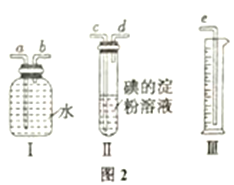
①若混合气体的流向按从左向右时,右图装置组装连接的顺序合理的是:混合气体→A (填写a、b等仪器接口字母)。___________
②你认为下列试剂中,可以用来代替试管中碘的淀粉溶液的是:______ (填标号);
A.酸性KMnO4溶液 B.NaOH 溶液 C.溴水 D.氨水
③若碘溶液的浓度为0.05 mol/L、体积为30 mL,与SO2气体恰好完全反应时,量简内水的体积为386.4 mL(已折算为标准状况下的体积)。则SO2的体积分数为:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,回答下列问题:
(1)元素周期表1~20号元素中,金属性最强的元素是__________(填元素符号,下同);属于稀有气体的是________________;非金属性最强的元素在周期表中的位置是_______________________。
(2)已知NO2和N2O4之间发生可逆反应:2NO2 (g) (红棕色) ![]() N2O4(g) (无色)。将装有NO2 和N2O4混合气体的烧瓶浸入热水中,观察到的现象是____________________,产生该现象的原因是____________________________________。
N2O4(g) (无色)。将装有NO2 和N2O4混合气体的烧瓶浸入热水中,观察到的现象是____________________,产生该现象的原因是____________________________________。
(3)一定条件下,向2L恒容密闭容器中按体积比1:3充入4.48L(标准状况)N2和H2的混合气体,发生反应N2(g)+3H2(g)![]() 2NH3(g),3min时反应达到平衡状态,测得c(N2)=0.02mol·L-1。
2NH3(g),3min时反应达到平衡状态,测得c(N2)=0.02mol·L-1。
① 0~3min内,v (NH3)=___________________。
②下列叙述可证明上述反应达到平衡状态的是_________(填序号)。
a. v(H2)= 3 v(N2) b.容器内压强保持不变
c.每消耗1mol N2,同时生成2mol NH3
d. N2、H2和NH3的物质的量浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用右图所示装置可以将温室气体CO2转化为燃料气体CO。下列说法中,不正确的是
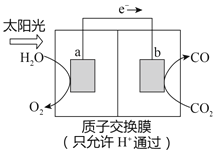
A. 电极b表面发生还原反应
B. 该装置工作时,H+从a极区向b极区移动
C. 该装置中每生成1molCO,同时生成0.5molO2
D. 该过程是将化学能转化为电能的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中位置如图所示,其中T所处的周期序数与主族序数相等, 请回答下列问题:
(1)T的原子结构示意图为 , R的最简单氢化物的电子式为 , Q的1:1型氢化物中相对分子质量最小的分子是型分子(立体构型).
(2)元素的非金属性为(原子的得电子能力):QW(填“强于”或“弱于”).
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为 .
(4)R有多种氧化物,其中氧化物甲的相对分子质量最小.在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com