
【题目】SO2是大气污染物之一,为探究SO2气体的性质,某实验小组利用如图1所示装置进行实验。
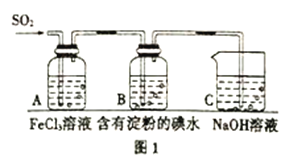
(1)装置A中发生反应的离子方程式为:______________;
(2)装置C的作用是:______________;
(3)在上述装置中通入过量的SO2,为了验证A 中SO2 与Fe3+发生了氧化还原反应,取A 中的溶液少 量,分成两份,并设计了如下实验方案:
方案①:向第一份溶液中加入少量酸性KMnO4溶液,发现紫红色褪去;
方案②,向第二份溶液中加入少量KSCN 溶液,发现不变红,再加入少量新制的氯水,深液变红;
上述方案中不合理的是:________,原因是: ________________;
(4)能表明I-的还原性弱于SO2 的现象是: ________________;
(5)设计实验验证反应结束后A 装置中的Cl-:________________;
(6) 该小组同学设计实验模报测定硫酸工业生产排放的尾气中SO2的体积分数(其他气体均难溶于水且不发生任何反应),选用了如图2所示的简易实验装置。
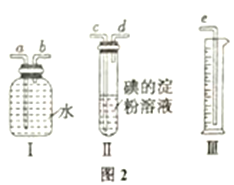
①若混合气体的流向按从左向右时,右图装置组装连接的顺序合理的是:混合气体→A (填写a、b等仪器接口字母)。___________
②你认为下列试剂中,可以用来代替试管中碘的淀粉溶液的是:______ (填标号);
A.酸性KMnO4溶液 B.NaOH 溶液 C.溴水 D.氨水
③若碘溶液的浓度为0.05 mol/L、体积为30 mL,与SO2气体恰好完全反应时,量简内水的体积为386.4 mL(已折算为标准状况下的体积)。则SO2的体积分数为:_______。
【答案】 SO2+2H2O +2Fe3+=2Fe2++SO42-+4H+ 吸收未反应的二氧化硫,防污梁空气 方案① 过量的二氧化硫能溶于水,也能使酸性高锰酸钾溶液褪色 B中蓝色褪去 取反应结束后A装置中适量溶液于试管中,先加入足量的Ba(NO3)2溶液,沉淀完全后取上层清液加适量的AgNO3溶液,观察是否有白色沉淀 c→d→b→a→e A、C 8%
【解析】(1)装置A中二氧化硫与铁离子发生氧化还原反应生成硫酸根和亚铁离子,反应的离子方程式为:SO2+2H2O+2Fe3+===2Fe2++SO42-+4H+。(2)二氧化硫有毒,会污染空气,所以要有尾气吸收装置,因此装置C的作用是吸收未反应的二氧化硫,防止污染空气。(3)由于过量的二氧化硫能溶于水,也能使酸性高锰酸钾溶液褪色,所以方案①不合理。(4)碘能与二氧化硫反应生成碘离子和硫酸根离子,则装置B中蓝色褪色,据此可判断I-的还原性弱于SO2。(5)要检验氯离子,需要排除硫酸根以及亚硫酸根离子的干扰,因此实验方案是:取反应结束后A装置中适量溶液于试管中,先加入足量的Ba(NO3)2溶液,沉淀完全后取上层清液加适量的AgNO3溶液,观察是否有白色沉淀;(6)①原料气通过碘的淀粉溶液,碘能氧化H2SO3,生成H2SO4,吸收二氧化硫气体,通过装置Ⅰ、Ⅲ排水量测定氮气的体积,因此连接装置接口顺序为:混合气体→A→c→d→b→a→e;②二氧化硫具有还原性,可以利用酸性高锰酸钾溶液吸收,且现象明显,氢氧化钠溶液虽能吸收二氧化硫但无明显现象,溴水可以吸收二氧化硫使其褪色,现象明显,氨水可以吸收二氧化硫,但无明显现象,答案选AC;③反应的方程式为I2+SO2+2H2O===2I-+SO42-+4H+,由条件知n(SO2)=n(I2)=0.05 mol/L×0.03 L=0.0015 mol,即33.6 mL,所以工业原料气总体积为 386.4 mL+33.6 mL=420.0 mL,因此其中SO2的体积分数为33.6/420×100%=8%。


科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是( ) 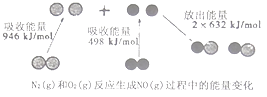
A.1molN2(g)和1molO2(g)反应放出的能量为180kJ
B.1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量
C.通常情况下,N2(g)和O2混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水解反应离子方程式书写正确的是( )
A.CH3COOH+OH﹣CH3COO﹣+H2O
B.S2﹣+2H2OH2S+2OH﹣
C.CH3COOH+H2OCH3COO﹣+H3O+
D.CO32﹣+H2OHCO3﹣+OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 分散质微粒直径的大小关系:溶液>胶体>浊液
B. 利用丁达尔效应可以区别溶液与胶体
C. 胶体粒子比较小,可以通过半透膜
D. 电泳现象可证明胶体属于电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某溶液中含有Na+、Ba2+、Fe3+三种阳离子,那么溶液中的阴离子可能是( )
A. SO42- B. Cl- C. OH- D. CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、丁是四种中学化学中常见的物质,其转化关系如图所示。则甲和丁不可能是
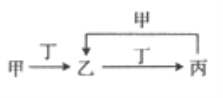
A. N2和O2 B. Cl2和Fe C. C和O2 D. SO2和NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还含有一定量的SiO2)可用于制备FeCO3,其流程如下:
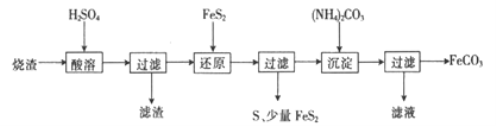
已知:还原时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应ⅠW为
FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+。
(1)反应Ⅰ中还原剂是_________
(2)滤渣的成分是_______(填名称)。
(3)所得FeCO3需充分洗涤,检验FeCO3是否洗净的方法是____________
(4)①配平反应的离子方程式: ![]() ____________
____________
②还原前后溶液中部分离子的浓度见下表(溶液体积变化忽略不计):
离子 | 离子浓度(mol/L) | |
还原前 | 还原后 | |
Fe2+ | 0.10 | 2.50 |
SO42- | 3.50 | 3.70 |
则反应Ⅰ、Ⅱ中生成Fe2+的物质的量之比为______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,单质A、B、C分别为固体、黄绿色气体与无色气体,在合适条件下,它们可以按下面的流程进行反应.又知E溶液是无色的.请回答: 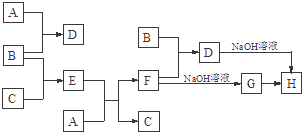
(1)写出E物质的化学式 .
(2)写出G→H的化学方程式 .
(3)写出B+F→D的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学查阅教材得知,普通锌锰电池筒内无机物质主要成分为MnO2、NH4Cl、ZnCl2等物质。他在探究废干电池内的黑色固体回收利用时,进行如图所示实验:下列有关实验的叙述中,不正确的是

A. 操作①中玻璃棒的作用是加快固体溶解速度
B. 操作②的操作名称是过滤
C. 操作③中盛放药品的仪器是坩埚
D. 操作④的目的是除去滤渣中杂质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com