
【题目】人们将有机物中连有四个不同原子(或原子团)的碳原子称为手性碳原子,如图所示烷烃X中含有一个手性碳原子(用*标记).回答下列问题: 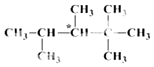
(1)烷烃X的名称是;其一氯代物共有种(不考虑立体异构,下同).
(2)含有手性碳原子的且式量最小的烷烃的化学式是 .
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。

回答下列问题:
(1)元素b在元素周期表中的位置是________。
(2)元素e的负一价离子的结构示意图为________,与元素g的简单离子,二者的离子半径大小顺序为________。(用离子符号表示)
(3)元素i的气态氢化物比元素e的气态氢化物________(填“稳定”或“不稳定”)。
(4)元素i的单质溶于元素f的最高价氧化物对应的水化物中,可生成具有漂白作用的一种盐,该盐的电子式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(化学式为 NaNO2)是一种常用的防腐剂,回答下列问题:
(1)NaNO2 中 N 元素的化合价为_________.
(2)亚硝酸钠在 320°C 时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。该反应的化学方程式_________________。
(3)我国规定火腿肠中亚硝酸钠添加标准为每千克食品含量不超过 150 毫克,以此计算,200g 15%的亚硝酸钠溶液至少可用于生产火腿肠______千克。
(4)在酸性条件下,NaNO2与按物质的量 1:1 恰好完全反应,且I-被氧化为 I2时,产物中含氮的物质为________(填化学式)。
(5)工业废水中的 NaNO2 可用铝粉除去,已知此体系中包含 AI、NaAlO2、NaNO2、NaOH、NH3、H2O 六种物质。该反应的化学方程式为____________。
(6)某同学设计实验对工业产品中 NaNO2 的含量进行测定,你取固体样品 2g,完全溶解配制成溶液 100mL 取出 25mL 溶液用 0.100 mol/L 酸性 KMnO4 溶液进行滴定(杂质不与 KMnO4 反应),实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.70 | 20.02 | 20.00 | 19.98 |
该样品中亚硝酸钠的质量分数为_________.(已知:5NO2-+2MnO4-+6H+ = 5NO3-+2Mn2++3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基吡啶(又名心痛定)是治疗心血管疾病的一种药物。目前采用如下图所示的合成路线来制取。

(1)B 的系统命名为________,C 中含有的含氧官能团名称为________。
(2)反应②的反应类型为_____反应。
(3)按照有机物的分类,硝基吡啶可属于______(填字母序号)。
A.醇类 B.酸类 C.高分子化合物 D.酯类 E.芳香族化合物
(4)写出以下反应的化学方程式:
①____________________
②____________________
(5)化合物 I 是 B 的同系物,相对分子质量比 B 多 14,I 有多种同分异构体,其中能满足下列条件的有_________种。
a.能与碳酸氢钠溶液反应放出气体 b.含有一 NH2 c.属于芳香族化合物
(6)写出以苯甲酸、乙醇和乙酸乙酯为原料合成物质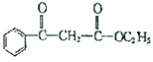 的流程图:(其他无机物原料任选)。(仿照
的流程图:(其他无机物原料任选)。(仿照 )______________________________。
)______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种重要的过渡金属元素,常见化合价为+6、+5、+4,金属钼广泛用于冶金、机械制造、电子、照明及一些高科技领域。钼酸钠(Na2MoO4)是一种无公害型冷却水系统的金属缓蚀剂,也可用于制造生物碱、油墨、化肥、钼红颜料等。如图是化工生产中制备金属钼和钼酸钠的主要流程图,已知钼精矿的主要成分为MoS2,钼酸难溶于水。
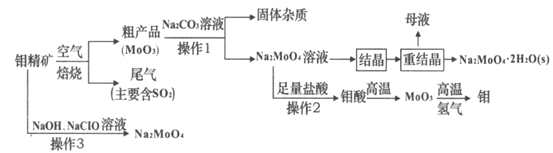
(1)MoS2焙烧时反应的化学方程式为________;产生的尾气对环境的主要危害是_______。
(2)操作1中,粗产品中的MoO3与Na2CO3溶液充分反应后,生成Na2MoO4和另外一种物质,该物质的电子式为_____。粗产品经过充分碱浸后所得的碱浸液中部分离子的浓度:c(MoO42-)=0.40mol·L-1,c(SO42-)=0.05mol·L-1。结晶前应先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4,开始沉淀时,SO42-的去除率为___。已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8
(3)该流程中操作2为过滤,如果在实验室模拟该操作时,发现滤液中有少量浑浊,从实验操作的角度分析,可能的原因是_______________________________。
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因______________________________________。
(5)工业上由MoO3制备Mo粉也常用铝热反应,写出该反应的方程式_______________。
(6)操作3在碱性条件下,将钼精矿加入到足量的NaC1O溶液中,也可以制备钼酸钠。该反应的离子方程式为___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com