
����Ŀ��A��B��C��D��E����Ԫ�ص�ԭ��������������Aԭ�������ӣ�B�ĵ����ڿ����к�����࣬C��DԪ��ͬ������ԭ������DΪC�Ķ�����EԪ�صļ۵����Ų�ʽΪ(n-l)dn+6ns1���ش��������⣺
��1��Ԫ��B�����ڱ��е�λ���� ��EԪ�ص�Ԫ�ط���Ϊ �������γ�E+��ԭ��Ϊ ��
��2��DԪ�ػ�̬ԭ�ӵĺ�����ӹ���Ų�ͼΪ![]() ��
��
��3��AԪ����CԪ���γ����ֳ����Ļ������ԭ�Ӹ����ȷֱ�Ϊ2��1��1��1�����ֻ������������Ȼ��ܣ�ԭ���� ������һ�ֻ�����������������½�KMnO4��ԭΪMn2+����ط�Ӧ�����ӷ���ʽΪ ��
���𰸡���1���ڶ�������A�� Cu 4s���ȫ�գ���3dȫ�����Ϻ��ع���Ƚ��ȶ�
��2��
��3��ˮ����������������֮�����γ����
2MnO4��+5H2O2+6H+��2Mn2++5O2��+8H2O
�����������������A��B��C��D��E����Ԫ�ص�ԭ��������������Aԭ�������ӣ���A��H��B�ĵ����ڿ����к�����࣬���B��N��C��DԪ��ͬ������ԭ������DΪC�Ķ���������C��O��D��S��EԪ�صļ۵����Ų�ʽΪ(n-l)dn+6ns1�����ݺ�������Ų����ɿ�֪n��4������E��Cu��
��1����Ԫ�������ڱ��е�λ���ǵڶ����ڵ���A�壻EԪ�ص�Ԫ�ط���ΪCu������4s���ȫ�գ���3dȫ�����Ϻ��ع���Ƚ��ȶ�������ͭ�����γ�Cu+��
��2��S��ԭ��������16�����ݺ�������Ų����ɿ�֪DԪ�ػ�̬ԭ�ӵĺ�����ӹ���Ų�ͼΪ ��
��
��3��AԪ����CԪ���γ����ֳ����Ļ������ԭ�Ӹ����ȷֱ�Ϊ2��1��1��1���ֱ�Ϊˮ��˫��ˮ������ˮ����������������֮�����γ�������������ֻ������������Ȼ��ܣ�����һ�ֻ�����������������½�KMnO4��ԭΪMn2+���û�������˫��ˮ��Ӧ�����ӷ���ʽΪ2MnO4��+5H2O2+6H+��2Mn2++5O2��+8H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ��������Ƶ�PEM��ѹ�������������Ľṹ��ͼ���ڵ�������м���ǹ������ʾۺ�Ĥ��Ĥ���߷ֱ��Ƕ�������Ͷ����������ˮ�����߽�������ˮ�������ˮ�䡣����˵������ȷ����
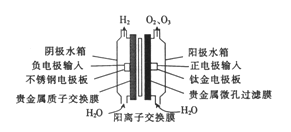
A. �������ҷ����ķ�Ӧ��2H2O-4e-=4H++O2����3H2O-6e-=6H++O3��
B. ͨ��ʱ��H+���������ƶ�
C. ��ͬ������O2��O3�����֮��С��H2�����
D. ����ʳ��ˮ���洿ˮ����Բ���ɷ�û��Ӱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��120��ʱ,2���ij����8���O2���,��ȫȼ�պ�ָ���ԭ�����¶Ⱥ�ѹǿ��������䣬�÷���ʽ��������̼ԭ������������( )
A. 1 B. 2 C. 3 D. 5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ֱ�߽��㴦��ԲȦΪNaCl������Na+���ӻ�Cl-����������λ�á�
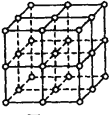
�����������ڿռ��������ഹֱ�ķ����϶��ǵȾ������еġ�
��1���뽫���д���Na+���ӵ�ԲȦͿ�ڣ����ؿ��������С���������NaCl����Ľṹʾ��ͼ��_______
��2�������У���ÿ��Na+���ӵ���Χ������ӽ����Ҿ�����ȵ�Na+���ӹ���_____����
��3��������ÿһ���ظ��Ľṹ��Ԫ�о�������NaCl��������������Ķ����ϡ����ϡ����ϵ�Na+��Cl-����Ϊ�þ����������ڵľ��������С�һ�������У�Cl-���ӵĸ�������______����______�������ʽ����Na+���ӵĸ�������_______����__________�������ʽ����
��4����NaCl��Ħ������ΪM g/mol��ʳ�ξ�����ܶ�Ϊ![]() g/cm3�������ӵ�����ΪNA��ʳ�ξ���������������������������ļ�ľ���Ϊ______cm��
g/cm3�������ӵ�����ΪNA��ʳ�ξ���������������������������ļ�ľ���Ϊ______cm��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���屽��һ�ֻ���ԭ�ϣ�ʵ���Һϳ��屽��װ��ʾ��ͼ���й��������£������кϳɲ���ش����⣺


��1������c������Ϊ___________���¶ȼƵ�������___________________________��
��2����a�м���30mL��ˮ����������м����b��С�ļ���8.0mLҺ̬�塣��a�е��뼸���壬�а�ɫ��������������Ϊ������_____���塣�����μ���Һ����꣬װ��d��������___________________;
��3��Һ�����������в�������ᴿ��
����a�м���15mLˮ��Ȼ����˳�ȥδ��Ӧ����м��
����Һ������10mLˮ��8mL10%��NaOH��Һ��10mLˮϴ�ӡ�NaOH��Һϴ�ӵ�������_____��
����ֳ��Ĵ��屽�м�����������ˮ�Ȼ��ƽ�����ˮ������á����ˡ�
��4�������Ϸ���������屽�л����е���Ҫ���ʵĽṹ��ʽΪ_________��Ҫ��һ���ᴿ�����в����б������____��������ȷѡ��ǰ����ĸ����
A.�ؽᾧ B.���� C.���� D.��ȡ
��5���ڸ�ʵ���У�a���ݻ����ʺϵ���_________��������ȷѡ��ǰ����ĸ����
A.25mL B.50mL C.100mL D. 250mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1 mol��L-1NaOH��Һ�ֱ�ζ�10mL��ͬŨ�ȵ�����ʹ��ᣨ������HA��ʾ�������õ絼�ʴ��������Ƶ絼��������ͼ��ʾ������˵������ȷ���ǣ� ��

A. b��pHֵ����1 B. ����Ũ��Ϊ 0.lmol��L-1
C. c�㣺c(Na+)>c(A-)>c(H+)>c(OH-) D. ���ߢ�Ϊ���ᣬ���ߢ�Ϊ������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���ʾʵ�飬����ͽ��۾���ȷ���ǣ� ��
ѡ�� | ʵ�� | ���� | ���� |
A | ��Ũ�Ⱦ�Ϊ0.lmol��L-1NaCl��NaI�����Һ�еμ�����AgNO3��Һ | ���ֻ�ɫ���� | Ksp(AgCl)>Ksp(AgI) |
B | �����£��ⶨ�����ʵ���Ũ�ȵ�Na2CO3��Na2SO3��Һ��pHֵ | ǰ�ߵ� pHֵ�Ⱥ��ߵĴ� | �ǽ����ԣ�S>C |
C | ��ij��Һ�еμ��������� | ��Һ�г��������ݺ͵���ɫ���� | ��Һ�к���S2-�� SO32- |
D | ��FeCl3��KSCN�����Һ�У���������KCl�Ĺ��� | ��Һ��ɫ��dz | FeCl3 +KSCN |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��5�л���ѧ����]
���з���ʽΪC10H10O2Br2�ķ����廯����X��X�б��������ĸ�ȡ�����������ϵ�һ�ȴ���ֻ��һ�֣���˴Ź�������ͼ�����ĸ����շ壬���շ�������Ϊ1:2:6:1����һ�������¿ɷ�������һϵ�з�Ӧ������C�ܷ���������Ӧ��E��FeCl3��Һ��ɫ������Ũ��ˮ��Ӧ��

��֪��
����ϡ����Һ�У����ڱ����ϵ���ԭ�Ӳ�����ˮ��
�������ǻ�ͬʱ����ͬһ̼ԭ���ϵĽṹ�Dz��ȶ��ģ������Զ�������ˮ��Ӧ��CH3CH(OH) 2��CH3CHO +H2O
�ش��������⣺
��1��X�й����ŵ�������____________��E��F��Ӧ������_____________
��2��I�Ľṹ��ʽΪ_________________��
��3��д�����з�Ӧ�Ļ�ѧ����ʽ��
X������ϡNaOH��Һ���ȵĻ�ѧ����ʽ��__________________________��
��4��ͬʱ��������������E��ͬ���칹�干��__________________�֣�
A�������ϵ�һ�ȴ��������� B�����ܷ���ˮ�ⷴӦ
C����FeCl3��Һ����ɫ D��1molE����ֱܷ���1molNaOH��2molNa��Ӧ
���к˴Ź�������Ϊ����壬�ҷ������Ϊ3:2:2:1:1:1��һ�ֽṹ��ʽΪ___________��
��5��![]() �������
�������![]() Ϊԭ����ȡ
Ϊԭ����ȡ ���ϳ�·��ͼ��______________
���ϳ�·��ͼ��______________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com