
| A、FeSO4在反应中作氧化剂 |
| B、随着反应的进行,该废水的pH会减小 |
| C、若该反应转移0.6mol e-,则会有0.2mol Cr2O72- 被还原 |
| D、除去废水中含铬元素离子的过程包括氧化还原反应和复分解反应 |


科目:高中化学 来源: 题型:
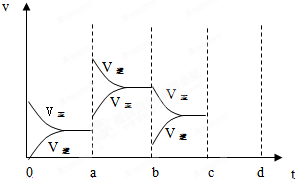
查看答案和解析>>
科目:高中化学 来源: 题型:

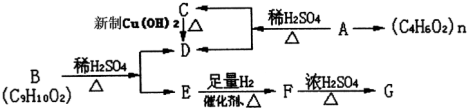
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器内压强不随时间的变化而变化 |
| B、容器内A、B、C、D四者共存 |
| C、A、D的消耗速率相等 |
| D、C、D的生成速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
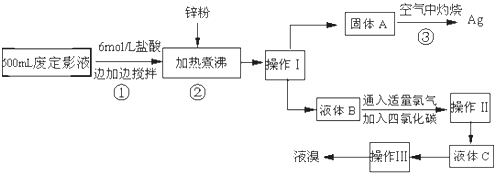
 用如图所示装置(夹持仪器已省略)进行实验,E为分液漏斗活塞.将液体A逐滴加入到固体B 中,请回答下列问题:
用如图所示装置(夹持仪器已省略)进行实验,E为分液漏斗活塞.将液体A逐滴加入到固体B 中,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、.金属钠与氧气反应,条件不同产物不同 |
| B、钠着火时可用水扑灭 |
| C、将钠保存在汽油中 |
| D、金属钠的化学性质活泼,可从硫酸铜溶液中置换出金属铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH2=CH2 |
| B、CH3CH=CH2 |
| C、CH3CH3 |
| D、CH3CH2CH=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaCl Na2SO4 |
| B、NaCl NaBr Na2SO4 |
| C、NaCl NaBr NaI Na2SO4 |
| D、NaCl NaI Na2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com