
| n |
| V |
| 消耗量 |
| 起始量 |
 ,
, ;
;| 0.52 |
| 0.52×0.25 |
| 0.5mol/L |
| 1mol/L |


科目:高中化学 来源: 题型:
| A、用酒精后静置则上层颜色加深 |
| B、用汽油二者混溶不分层 |
| C、用CCl4后静置则上层颜色变浅,下层颜色加深 |
| D、用汽油后静置则上层颜色变浅,下层颜色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、n | B、2n | C、3n | D、4n |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加水 |
| B、加热 |
| C、加CH3COONa固体 |
| D、加很稀的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 浙江省“五水共治”是水质治理的重要举措,其中化学需氧量(COD)是水质测定中的重要指标,可以反映水中有机物等还原剂的污染程度.COD是指在一定条件下,用强氧化剂氧化水样中的还原剂及有机物时所消耗氧化剂的量,然后折算成氧化水样中的这些还原剂及有机物时需要氧气的量.某学习小组用重铬酸钾法测定某水样中的COD.主要的实验装置、仪器及具体操作步骤如下:实验装置及仪器:
浙江省“五水共治”是水质治理的重要举措,其中化学需氧量(COD)是水质测定中的重要指标,可以反映水中有机物等还原剂的污染程度.COD是指在一定条件下,用强氧化剂氧化水样中的还原剂及有机物时所消耗氧化剂的量,然后折算成氧化水样中的这些还原剂及有机物时需要氧气的量.某学习小组用重铬酸钾法测定某水样中的COD.主要的实验装置、仪器及具体操作步骤如下:实验装置及仪器: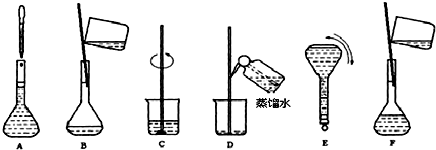
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeSO4在反应中作氧化剂 |
| B、随着反应的进行,该废水的pH会减小 |
| C、若该反应转移0.6mol e-,则会有0.2mol Cr2O72- 被还原 |
| D、除去废水中含铬元素离子的过程包括氧化还原反应和复分解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com