
【题目】有一透明溶液,可能含有Al3+、Fe3+、K+、NH4+、Mg2+和Cu2+等离子中的一种或几种。现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀。加入Na2O2的量与生成白色沉淀的量之间的关系用图来表示。
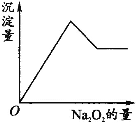
试推断:
(1)原溶液中一定含有________。
(2)一定不含有________。
(3)可能含有________。
(4)为了进一步确定可能含有的离子,应增加的实验方法为________。
【答案】Al3+和Mg2+ Fe3+、NH4+、Cu2+ K+ 焰色反应
【解析】
根据离子共存的条件和离子检验方法分析。
(1) 加入Na2O2粉末后,Na2O2与水反应生成NaOH和O2,只有无色无味的气体放出,说明只有O2放出,故一定不含有NH4+,析出白色沉淀,说明一定没有Fe3+和Cu2+,有可能含有Al3+和Mg2+,从图像中可知,沉淀量变化有生成也有溶解,说明一定含有Al3+和Mg2+; (2)一定不含有Fe3+、NH4+、Cu2+;
(3)从已知条件中,未获得信息可以证明K+是否存在,故K+可能存在;
(4)为了验证K+是否存在,可以用焰色反应,透过蓝色故玻璃观察是否有蓝色出现;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 5.4 g Al分别与含溶质0.2 mol的NaOH溶液、盐酸反应,生成H2的分子数均为0.3NA
B. 5.35 g NH4Cl固体中含有N—H键的个数为0.4NA
C. 一定量的钠与8 g氧气作用,若两者均无剩余,转移的电子数为NA
D. 0.2molNH3与0.2molO2在催化剂的作用下加热充分反应,所得NO的分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为了探究Fe(NO3)3的热稳定性和氧化性,设计如下实验:
实验(一): 热稳定性
利用如图装置进行实验,加热A中Fe(NO3)3固体,A 和B中都有红棕色气体产生,A 试管中生成了红色粉末。
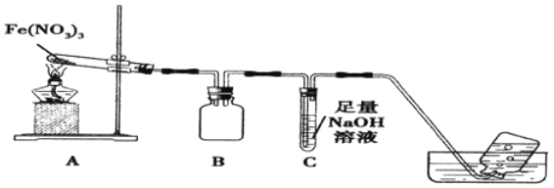
(1)B装置的作用____________;要检验A中红色固体是否为Fe2O3,应该选用的试剂是____________(填化学式)。
(2)加热A中试管一段时间后,C 中导管口有气泡产生,而集气瓶中无气泡产生原因是______________。
(3)写出硝酸铁受热分解的化学方程式__________________。
实验(二):氧化性
Fe3+和Ag+的氧化性相对强弱一直是实验探究的热点。该小组设计如下实验:
试验编号 | 实验操作 | 现象 |
a | 向10mL3mol·L-1KNO3酸性溶液(pH=1)中插入一根洁净的银丝,并滴加氯化钠溶液 | 无沉淀生成 |
b | 向10mL3mol·L-1AgNO3溶液中滴加2mL0.1mol·L-1FeSO4溶液,振荡;再滴加酸性高锰酸钾溶液 | 紫红色溶液不褪色 |
c | 向10 mL3mol·L-1Fe(NO3)3溶液(pH=1)中插入一根洁净的银丝,并滴加氯化钠溶液 | 产生白色沉淀 |
(4)设计实验a的目的是_____________________;实验c的结论是_____________________________。
(5)实验b涉及反应的离子方程式为____________________________________。
(6)实验结论是Fe3+、Ag+氧化性的相对强弱与离子的_____________________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A. 苯甲酸(![]() )分子中所有原子不可能在同一平面上
)分子中所有原子不可能在同一平面上
B. 苯和甲苯可用酸性KMnO4溶液鉴别
C. 食用花生油和鸡蛋清都能发生水解反应
D. 篮烷(结构简式如图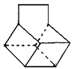 )的一氯代物有4种(不含立体异构)
)的一氯代物有4种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人教版高中化学选修4实验2-3中用到了硫代硫酸钠,某化学兴趣小组对这一物质展开了如下探究。

实验一.制备Na2S2O3·5H2O
通过查阅资料,该化学兴趣小组设计了如下的装置(略去部分夹持仪器)来制取Na2S2O3·5H2O晶体。
已知烧瓶C中发生如下三个反应:
Na2S(aq)+H2O(l)+SO2(g) = Na2SO3(aq)+H2S(aq)
2H2S(aq)+SO2(g) =3S(s)+2H2O(l) ; S(s)+Na2SO3(aq) ![]() Na2S2O3(aq)
Na2S2O3(aq)
(1)写出A中的化学反应方程式___________________________________。
(2)装置B的作用之一是观察SO2的生成速率。控制SO2生成速率可以采取的措施有_________________________(写一条)
(3)装置E的作用是____________________。
(4)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为_________________________。
实验二.性质探究
(5)常温下,用pH试纸测定0.1 mol·L-1 Na2S2O3溶液pH值约为8,测定时的具体操作是_______________________________________________________。
(6)向新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,有硫酸根离子生成,写出该反应的离子化学方程式________________________________________。
实验三.Na2S2O3的应用
(7)用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解。此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.0100 mol·L-1的Na2S2O3标准溶液进行滴定,反应完全时,相关数据记录如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗Na2S2O3标准溶液的体积/mL | 18.02 | 20.03 | 17.98 | 18.00 |
部分反应的离子方程式为:① Cr2O72-+6I-+14H+===3I2+2Cr3++7H2O
② I2+2S2O32-===S4O62-+2I-
滴定时Na2S2O3标准溶液应该用_____________________(填仪器名称)盛装,该废水中Ba2+的物质的量浓度为_______________________span>。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,磷酸二氢钾(KH2PO4)大晶体已应用于我国研制的巨型激光器“神光二号”中。利用氟磷灰石(化学式为Ca5P3FO12)制备磷酸二氢钾的工艺流程如下图所示(部分流程步骤已省略):

已知萃取的主要反应原理:KCl+H3PO4![]() KH2PO4+HCl;其中,反应产生的HCl易溶于有机萃取剂。
KH2PO4+HCl;其中,反应产生的HCl易溶于有机萃取剂。
请回答下列问题:
(1)流程中将氟磷灰石粉碎的目的是__________________________________。
(2)不能使用二氧化硅陶瓷材质的沸腾槽的主要原因是___________________(用化学方程式表示)。
(3)副产品N的化学式是____________;在得到KH2PO4晶体的一系列操作Ⅲ,其主要包括______________________________、过滤、洗涤、干燥等。
(4)若用1000kg质量分数为50.4%的氟磷灰石(化学式为Ca5P3FO12)来制取磷酸二氢钾晶体,其产率为80%,则理论上可生产KH2PO4的质量为_______kg。
(5)电解法制备KH2PO4的装置如图所示.该电解装置中,a 区属于_______区(填“阳极”或“阴极”),阴极区的电极反应式是______________________________________。

(6)工业上还可以用氟磷灰石与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,同时逸出SiF4和CO,该反应的化学方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年冬季,我省多次出现大范围雾霾天气.下列防止雾霾产生的措施中,不可行的是( )
A.停止冬季供暖,减少有害物质排放
B.对锅炉和汽车等产生的有害气体和烟尘进行处理
C.退耕还林,改善生态环境
D.寻找新能源,减少化石燃料的使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮类化合物在人类的日常生活中有着重要的作用。
(1)研究表明,在200℃,压强超过200MPa时,不使用催化剂,氨便可以顺利合成。但工业上合成NH3往往在温度500℃压强20~50MPa的条件下进行,已知合成氨为放热反应,试分析原因________________________________。
(2)已知:A.2NH3(g)+CO2(g)![]() NH2COONH4(l) ΔH=-123kJ/mol
NH2COONH4(l) ΔH=-123kJ/mol
B. NH2COONH4(l)![]() (NH2)2CO(g)+H2O(g) ΔH= +50kJ/mol
(NH2)2CO(g)+H2O(g) ΔH= +50kJ/mol
①在工业生产中,尿素是由以上A、B两步合成的,则工业上由氨气与二氧化碳合成尿素的热化学反应方程式为:__________________________________。
②尿素合成过程中通过控制温度、NH3和CO2的物质的量比(氨碳比a)等因素来提高CO2的转化率。如图是在其他因素一定,不同氨碳比条件下CO2平衡转化率与温度的关系图。由图可知当温度一定时,a值越大,CO2转化率越大其原因是_____________________;当a一定时,CO2平衡转化率呈现先增大后减小的趋势,其原因为_______________________________。

(3)工业上常利用4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)生产硝酸。在同温条件下,向2L的反应容器中充入2mol NH3与2.75molO2,平衡时NH3转化率为50%,则该温度下K=________________;保持温度不变,反应容器中每种物质各增加0.1mol,则平衡将___________移动;其他条件不变,下列措施一定可以增大氨气转化率的是_________________。
4NO(g)+6H2O(g)生产硝酸。在同温条件下,向2L的反应容器中充入2mol NH3与2.75molO2,平衡时NH3转化率为50%,则该温度下K=________________;保持温度不变,反应容器中每种物质各增加0.1mol,则平衡将___________移动;其他条件不变,下列措施一定可以增大氨气转化率的是_________________。
a.降低氨气浓度 b.增大容器体积 c.降低温度 d.移除水蒸气 e.选择合适的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com