
【题目】含氮类化合物在人类的日常生活中有着重要的作用。
(1)研究表明,在200℃,压强超过200MPa时,不使用催化剂,氨便可以顺利合成。但工业上合成NH3往往在温度500℃压强20~50MPa的条件下进行,已知合成氨为放热反应,试分析原因________________________________。
(2)已知:A.2NH3(g)+CO2(g)![]() NH2COONH4(l) ΔH=-123kJ/mol
NH2COONH4(l) ΔH=-123kJ/mol
B. NH2COONH4(l)![]() (NH2)2CO(g)+H2O(g) ΔH= +50kJ/mol
(NH2)2CO(g)+H2O(g) ΔH= +50kJ/mol
①在工业生产中,尿素是由以上A、B两步合成的,则工业上由氨气与二氧化碳合成尿素的热化学反应方程式为:__________________________________。
②尿素合成过程中通过控制温度、NH3和CO2的物质的量比(氨碳比a)等因素来提高CO2的转化率。如图是在其他因素一定,不同氨碳比条件下CO2平衡转化率与温度的关系图。由图可知当温度一定时,a值越大,CO2转化率越大其原因是_____________________;当a一定时,CO2平衡转化率呈现先增大后减小的趋势,其原因为_______________________________。

(3)工业上常利用4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)生产硝酸。在同温条件下,向2L的反应容器中充入2mol NH3与2.75molO2,平衡时NH3转化率为50%,则该温度下K=________________;保持温度不变,反应容器中每种物质各增加0.1mol,则平衡将___________移动;其他条件不变,下列措施一定可以增大氨气转化率的是_________________。
4NO(g)+6H2O(g)生产硝酸。在同温条件下,向2L的反应容器中充入2mol NH3与2.75molO2,平衡时NH3转化率为50%,则该温度下K=________________;保持温度不变,反应容器中每种物质各增加0.1mol,则平衡将___________移动;其他条件不变,下列措施一定可以增大氨气转化率的是_________________。
a.降低氨气浓度 b.增大容器体积 c.降低温度 d.移除水蒸气 e.选择合适的催化剂
【答案】 温度太低反应太慢,压强太大对设备要求较高,压强太低转化率下降 2NH3(g)+CO2(g) ![]() (NH2)2CO(g) +H2O(g) ΔH=-73kJ/mol a值越大,NH3占反应物比例高,平衡向正向移动提高了CO2转化率 前半段B反应为主导因素,温度升高,促进B反应向正向移动,后半段A反应为主导因素,A反应向逆向移动 0.75 逆向(或向左) abd
(NH2)2CO(g) +H2O(g) ΔH=-73kJ/mol a值越大,NH3占反应物比例高,平衡向正向移动提高了CO2转化率 前半段B反应为主导因素,温度升高,促进B反应向正向移动,后半段A反应为主导因素,A反应向逆向移动 0.75 逆向(或向左) abd
【解析】试题分析:本题考查合成NH3适宜条件的选择,盖斯定律的应用,化学平衡图像的分析,化学平衡常数的计算和应用,外界条件对化学平衡的影响。
(1)工业合成氨的反应为N2+3H2![]() 2NH3;工业上合成NH3使用500℃不使用200℃的原因是:温度太低反应速率太慢,且在500℃时催化剂的催化活性最好。工业上合成NH3使用20~50MPa不使用200MPa的原因是:压强太低反应速率慢且反应物转化率低;虽然增大压强既能加快反应速率也能提高NH3的产率,但压强太大对设备要求较高,在经济上不合算。
2NH3;工业上合成NH3使用500℃不使用200℃的原因是:温度太低反应速率太慢,且在500℃时催化剂的催化活性最好。工业上合成NH3使用20~50MPa不使用200MPa的原因是:压强太低反应速率慢且反应物转化率低;虽然增大压强既能加快反应速率也能提高NH3的产率,但压强太大对设备要求较高,在经济上不合算。
(2)①工业上用NH3与CO2反应生成(NH2)2CO和H2O,应用盖斯定律,将A+B得,2NH3(g)+CO2(g)![]() (NH2)2CO(g)+H2O(g)ΔH=(-123kJ/mol)+(+50kJ/mol)=-73kJ/mol,工业上由NH3和CO2合成尿素的热化学方程式为:2NH3(g)+CO2(g)
(NH2)2CO(g)+H2O(g)ΔH=(-123kJ/mol)+(+50kJ/mol)=-73kJ/mol,工业上由NH3和CO2合成尿素的热化学方程式为:2NH3(g)+CO2(g)![]() (NH2)2CO(g)+H2O(g)ΔH=-73kJ/mol。
(NH2)2CO(g)+H2O(g)ΔH=-73kJ/mol。
②由图可知当温度一定时,a值越大,CO2转化率越大,其原因是:a值越大,NH3占反应物的比例越大,平衡向正反应方向移动,提高CO2的转化率。当a一定时,升高温度CO2平衡转化率呈现先增大后减小的趋势,其原因是:前半段(最高点之前)B反应为主导因素,温度升高,促进B反应向正向移动,后半段(最高点之后)A反应为主导因素,升高温度,A反应向逆向移动。
(3)用三段式,4NH3(g)+ 5O2(g)![]() 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
c(起始)(mol/L)1 1.375 0 0
c(转化)(mol/L)1![]() 50%=0.5 0.625 0.5 0.75
50%=0.5 0.625 0.5 0.75
c(平衡)(mol/L)0.5 0.75 0.5 0.75
该温度下K=![]() =
=![]() =0.75。保持温度不变,反应容器中每种物质各增加0.1mol,瞬时NH3、O2、NO、NH3物质的量浓度依次为0.55mol/L、0.8mol/L、0.55mol/L、0.8mol/L,此时Qc=
=0.75。保持温度不变,反应容器中每种物质各增加0.1mol,瞬时NH3、O2、NO、NH3物质的量浓度依次为0.55mol/L、0.8mol/L、0.55mol/L、0.8mol/L,此时Qc=![]() =0.8
=0.8![]() 0.75,平衡将逆向移动。a项,其他条件不变时,降低氨气浓度,平衡向逆反应方向移动,O2的转化率减小,NH3的转化率增大;b项,增大容器体积,即减小压强,平衡向正反应方向移动,NH3的转化率增大;c项,由于该反应是放热反应还是吸热反应未知,无法判断降低温度,平衡移动的方向,无法判断NH3的转化率是增大还是减小;d项,移除水蒸气,平衡向正反应方向移动,NH3的转化率增大;e项,使用合适催化剂能加快反应速率,平衡不移动,NH3的转化率不变;一定可以增大氨气转化率的是abd,答案选abd。
0.75,平衡将逆向移动。a项,其他条件不变时,降低氨气浓度,平衡向逆反应方向移动,O2的转化率减小,NH3的转化率增大;b项,增大容器体积,即减小压强,平衡向正反应方向移动,NH3的转化率增大;c项,由于该反应是放热反应还是吸热反应未知,无法判断降低温度,平衡移动的方向,无法判断NH3的转化率是增大还是减小;d项,移除水蒸气,平衡向正反应方向移动,NH3的转化率增大;e项,使用合适催化剂能加快反应速率,平衡不移动,NH3的转化率不变;一定可以增大氨气转化率的是abd,答案选abd。


科目:高中化学 来源: 题型:
【题目】有一透明溶液,可能含有Al3+、Fe3+、K+、NH4+、Mg2+和Cu2+等离子中的一种或几种。现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀。加入Na2O2的量与生成白色沉淀的量之间的关系用图来表示。
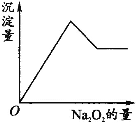
试推断:
(1)原溶液中一定含有________。
(2)一定不含有________。
(3)可能含有________。
(4)为了进一步确定可能含有的离子,应增加的实验方法为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2FeO4是制造高铁电池的重要原料,同时也是一种新型的高效净水剂。在工业上通常利用如图装置生产Na2FeO4,下列有关说法不正确的是

A. 右侧电极反应方程式:Fe+8OH--6e-=FeO42-+4H2O
B. 左侧为阳离子交换膜,当Cu电极生成1mol气体时,有2molNa+通过阳离子交换膜
C. 可以将左侧流出的氢氧化钠补充到该装置中部,以保证装置连续工作
D. Na2FeO4具有强氧化性且产物为Fe3+,因此可以利用Na2FeO4除去水中的细菌、固体颗粒以及Ca2+等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中,不正确的是( )
A. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,使用催化剂可以加快该反应的速率.
B. FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
C. 室温下,pH=4的NaHSO4溶液中,水电离出的H+浓度为1×10-10 mol/L
D. Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在①蛋白质 ②油脂 ③淀粉 ④葡萄糖⑤纤维素四种物质中,水解后能生成氨基酸的是_________(填序号,下同),遇碘水变蓝的是___________,在人体中不能直接被消化吸收的是____________,水解后能生成高级脂肪酸和甘油的是______________,不能水解的是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝-石墨双离子电池是一种高效电池。原理为:AlLi + Cx(PF6)![]() Al+xC+Li++PF6-,电池结构如图所示。下列说法正确的是
Al+xC+Li++PF6-,电池结构如图所示。下列说法正确的是

A. 放电时外电路中电子向铝锂电极移动
B. 放电时正极反应为Cx(PF6)+e-= xC+ PF6-
C. 充电时,铝石墨电极上发生还原反应
D. 以此电池为电源,电解NaCl饱和溶液,当生成11.2LH2时,电池负极质量减少7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置。其中E瓶中放有干燥红色布条;F中为铜网,F右端出气管口附近放有脱脂棉。
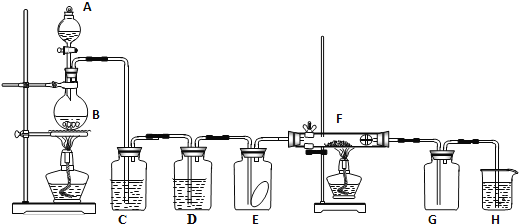
(1)写出制备氯气的反应方程式并用双线桥标明电子转移过程___________。
(2)C中试剂是_______;D中试剂的作用是_________。
(3)E中现象是_____________;F中现象是________;H中发生反应的化学方程式为___________________。
(4)KMnO4与浓盐酸反应也能产生氯气,请配平以下方程式:
____KMnO4 + ____HCl=____KCl + ____MnCl2 + ____Cl2↑ + ____H2O。
若反应产生0.1 mol Cl2,则转移的电子数目为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com