
【题目】下列有关说法中,不正确的是( )
A. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,使用催化剂可以加快该反应的速率.
B. FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
C. 室温下,pH=4的NaHSO4溶液中,水电离出的H+浓度为1×10-10 mol/L
D. Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
【答案】B
【解析】A. 因催化剂可降低反应的活化能,使反应速率加快,故A正确;B. FeCl3和MnO2均可做H2O2分解的催化剂加快H2O2分解,同等条件下二者对H2O2分解催化效果不相同,则反应速率的改变不同,故B错误;C. NaHSO4溶于水完全电离为钠离子、氢离子和硫酸根离子,溶液显酸性,水的电离被抑制,溶液中的氢氧根离子全部来自于水的电离,溶液的pH=4,氢离子浓度c(H+)=104mol/L,则c(OH)=1010mol/L,因水电离出的氢离子和水电离出的氢氧根离子的浓度相同,所以溶液中水电离出的H+浓度为1×1010mol/L,故C正确;D. Mg(OH)2固体在溶液中存在溶解平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),NH4Cl溶液中NH4+水解使溶液呈酸性,会消耗Mg(OH)2溶解平衡中的OH-,使Mg(OH)2(s)
Mg2+(aq)+2OH-(aq),NH4Cl溶液中NH4+水解使溶液呈酸性,会消耗Mg(OH)2溶解平衡中的OH-,使Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq)平衡正向移动,即Mg(OH)2固体可溶于NH4Cl溶液,故D正确;答案选B。
Mg2+(aq)+2OH-(aq)平衡正向移动,即Mg(OH)2固体可溶于NH4Cl溶液,故D正确;答案选B。


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某学习小组为了探究Fe(NO3)3的热稳定性和氧化性,设计如下实验:
实验(一): 热稳定性
利用如图装置进行实验,加热A中Fe(NO3)3固体,A 和B中都有红棕色气体产生,A 试管中生成了红色粉末。
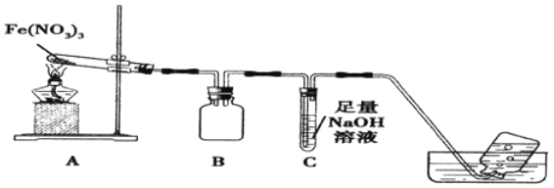
(1)B装置的作用____________;要检验A中红色固体是否为Fe2O3,应该选用的试剂是____________(填化学式)。
(2)加热A中试管一段时间后,C 中导管口有气泡产生,而集气瓶中无气泡产生原因是______________。
(3)写出硝酸铁受热分解的化学方程式__________________。
实验(二):氧化性
Fe3+和Ag+的氧化性相对强弱一直是实验探究的热点。该小组设计如下实验:
试验编号 | 实验操作 | 现象 |
a | 向10mL3mol·L-1KNO3酸性溶液(pH=1)中插入一根洁净的银丝,并滴加氯化钠溶液 | 无沉淀生成 |
b | 向10mL3mol·L-1AgNO3溶液中滴加2mL0.1mol·L-1FeSO4溶液,振荡;再滴加酸性高锰酸钾溶液 | 紫红色溶液不褪色 |
c | 向10 mL3mol·L-1Fe(NO3)3溶液(pH=1)中插入一根洁净的银丝,并滴加氯化钠溶液 | 产生白色沉淀 |
(4)设计实验a的目的是_____________________;实验c的结论是_____________________________。
(5)实验b涉及反应的离子方程式为____________________________________。
(6)实验结论是Fe3+、Ag+氧化性的相对强弱与离子的_____________________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年冬季,我省多次出现大范围雾霾天气.下列防止雾霾产生的措施中,不可行的是( )
A.停止冬季供暖,减少有害物质排放
B.对锅炉和汽车等产生的有害气体和烟尘进行处理
C.退耕还林,改善生态环境
D.寻找新能源,减少化石燃料的使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的短周期主族元素a、b、c、d和e中,a的最外层电子数为其周期数的二倍;b、d 的最简单氢化物为A2B型,且b、d 的最外层电子数之和等于a、c、e的最外层电子数之和,c的+1价离子比e的- 1价离子少8个电子。下列说法正确的是
A. 简单离子的半径:e>d>b>c B. 最高价氧化物对应的水化物的酸性强弱:e>d>a
C. 简单氢化物的沸点:b>d>c D. 简单离子的还原性:b>e>d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】24mL浓度为0.05mol/L的Na2SO3溶液恰好与20mL浓度0.02mol/L的K2Cr2O7溶液完全反应。已知Na2SO3被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为
A.+2B.+3C.+4D.+5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮类化合物在人类的日常生活中有着重要的作用。
(1)研究表明,在200℃,压强超过200MPa时,不使用催化剂,氨便可以顺利合成。但工业上合成NH3往往在温度500℃压强20~50MPa的条件下进行,已知合成氨为放热反应,试分析原因________________________________。
(2)已知:A.2NH3(g)+CO2(g)![]() NH2COONH4(l) ΔH=-123kJ/mol
NH2COONH4(l) ΔH=-123kJ/mol
B. NH2COONH4(l)![]() (NH2)2CO(g)+H2O(g) ΔH= +50kJ/mol
(NH2)2CO(g)+H2O(g) ΔH= +50kJ/mol
①在工业生产中,尿素是由以上A、B两步合成的,则工业上由氨气与二氧化碳合成尿素的热化学反应方程式为:__________________________________。
②尿素合成过程中通过控制温度、NH3和CO2的物质的量比(氨碳比a)等因素来提高CO2的转化率。如图是在其他因素一定,不同氨碳比条件下CO2平衡转化率与温度的关系图。由图可知当温度一定时,a值越大,CO2转化率越大其原因是_____________________;当a一定时,CO2平衡转化率呈现先增大后减小的趋势,其原因为_______________________________。

(3)工业上常利用4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)生产硝酸。在同温条件下,向2L的反应容器中充入2mol NH3与2.75molO2,平衡时NH3转化率为50%,则该温度下K=________________;保持温度不变,反应容器中每种物质各增加0.1mol,则平衡将___________移动;其他条件不变,下列措施一定可以增大氨气转化率的是_________________。
4NO(g)+6H2O(g)生产硝酸。在同温条件下,向2L的反应容器中充入2mol NH3与2.75molO2,平衡时NH3转化率为50%,则该温度下K=________________;保持温度不变,反应容器中每种物质各增加0.1mol,则平衡将___________移动;其他条件不变,下列措施一定可以增大氨气转化率的是_________________。
a.降低氨气浓度 b.增大容器体积 c.降低温度 d.移除水蒸气 e.选择合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于加成反应的是( )
A.甲烷燃烧生成二氧化碳和水
B.乙醇与氧气反应生成乙醛和水
C.乙烯与溴反应生成1,2—二溴乙烷
D.甲烷与氯气反应生成一氯甲烷和氯化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍有广泛的用途.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是
(已知:氧化性Fe2+<Ni2+<Cu2+)
A. 阳极发生还原反应,其电极反应式:Ni2++2e-===Ni
B. 电解过程中,阳极质量的减少与阴极质量的增加相等
C. 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D. 电解后,电解槽底部的阳极泥中只有Cu和Pt
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com