
【题目】对温室气体CO2进行减排和综合治理具有重要意义。回答下列问题:
Ⅰ. O2辅助的Al~CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。

(1)电池的负极反应式:______________________________________________ 。电池的正极反应式:6O2+6e![]() 6O2 ;6CO2+6O2
6O2 ;6CO2+6O2![]() 3C2O42 + 6O2
3C2O42 + 6O2
(2)反应过程中O2的作用是________。
(3)该电池的总反应式:_________________________________。
Ⅱ. CH4-CO2催化重整不仅对温室气体的减排具有重要意义,还可以得到合成气(CO和H2)。
已知:①CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1 =+206.2 kJ/mol K1
②CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH2 = +165.0 kJ/mol K2
(4)写出该催化重整反应的热化学方程式__________________________________________。
K=_________(用 K1 、K2表示)
(5)恒温恒压下,向容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,此时体积为2 L,一段时间后达到平衡时,CO2的转化率是50%,其平衡常数为_______。
(6)分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体让其发生催化重整反应。两容器中反应达平衡后放出或吸收的热量较多的是_______(填“A” 或“B ”)。
(7)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如下图:
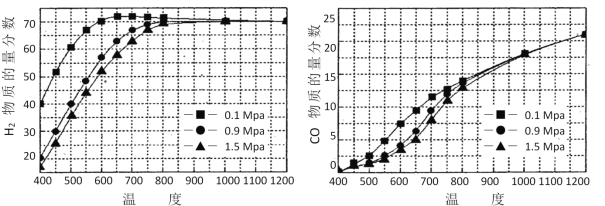
若要达到H2物质的量分数>65%、CO的物质的量分数<10%,以下条件中最合适的是___。
A.600℃,0.9Mpa B.700℃,0.9MPa C.800℃,1.5Mpa D.1000℃,1.5MPa
【答案】Al–3e–=Al3+(或2Al–6e–=2Al3+)催化剂2Al+6CO2=Al2(C2O4)3CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH =+247.4 kJ/molK=K12/K20.1875 mol2/ L2BB
【解析】
Ⅰ.(1)Al~CO2电池的负极为铝,正极为多孔碳电极,所以负极反应式为Al–3e–=Al3+(或2Al–6e–=2Al3+);
(2)由于反应前后氧气的量没有发生变化,所以氧气的作用为催化剂;
(3)电池的反应产物为Al2(C2O4)3,所以反应的总方程式为2Al+6CO2=Al2(C2O4)3;
因此,本题正确答案为:Al–3e–=Al3+(或2Al–6e–=2Al3+);催化剂;2Al+6CO2=Al2(C2O4)3;
Ⅱ.(4)根据盖斯定律,①![]() 2-②,得重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g),所以ΔH=ΔH1
2-②,得重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g),所以ΔH=ΔH1![]() 2-ΔH2=(+206.2 kJ/mol)
2-ΔH2=(+206.2 kJ/mol)![]() 2-(+165.0 kJ/mol)= +247.4 kJ/mol;平衡常数K=
2-(+165.0 kJ/mol)= +247.4 kJ/mol;平衡常数K=![]() =K12/K2,
=K12/K2,
因此,本题正确答案为:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH2 =+247.4 kJ/mol ;K=K12/K2;
(5) CH4(g)+CO2(g)=2CO(g)+2H2(g)
起始(mol) 2 1 0 0
变化(mol) 0.5 0.5 1 1
平衡(mol)1.5 0.5 1 1
根据同温同压下,V1/V2=n1/n2,则平衡时容器的容积为![]() 2L=
2L=![]() L,平衡时各物质的浓度为:c(CH4)=
L,平衡时各物质的浓度为:c(CH4)=![]() =
=![]() mol/L,c(CO2)=
mol/L,c(CO2)=![]() =
=![]() mol/L,c(H2)=c(CO)=
mol/L,c(H2)=c(CO)=![]() =
=![]() mol/L,
mol/L,
则平衡常数K=![]() =
=![]() =
=![]() mol2/ L2=0.1875 mol2/ L2,
mol2/ L2=0.1875 mol2/ L2,
因此,本题正确答案为:0.1875 mol2/ L2;
(6)该反应在反应时压强是不断增大的,由于B是恒压,相对于A来说是减小压强,所以B中的反应会在A的基础上正向进行,因此会吸收更多的热量,故选B。
因此,本题正确答案为:B;
(7)由图中数据可知,0.9 MPa时,H2的物质的量分数>65%,CO物质的量分数<10%,则700℃符合,1.5 MPa时,H2的物质的量分数>65%,CO物质的量分数<10%,则温度要高于750℃,低于约725℃,矛盾,故B正确,ACD错误,
因此,本题正确答案为:B。


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
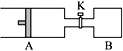
【题目】如图所示向A中充入1 mol X 、1 mol Y,向B中充入2 mol X、2 mol Y,起始时,v(A)=v(B)=a L。在相同温度和有催化剂存在下,两容器中各自发生下述反应:X+Y![]() 2Z+W;(X、Y、Z、W均为气体)正反应为放热反应,达到平衡时,v(A)=1.2a L。
2Z+W;(X、Y、Z、W均为气体)正反应为放热反应,达到平衡时,v(A)=1.2a L。
试回答:
(1)A中X的转化率α(A)_______________________________________________________。
(2)A、B中X的转化率的关系:α(A) ___________α(B)。(填“<”“>”或“=”)
(3)打开K,一段时间又达到平衡,A的体积为___________L。(连通管中气体体积不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是反应A(g) + 3B(g) 2C(g) + 2D(g) 在四种不同情况下的反应速率,反应速率最大的是
A. υ(A)=0.45mol·L-1·s-1B. υ(B)=0.6mol·L-1·s-1
C. υ(C)=0.4mol·L-1·s-1D. υ(D)=0.45mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种可做融雪剂的盐,其主要成分的化学式为XY2 , X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1mol XY2含有54mol电子。
(1)该融雪剂的化学式是_________;用电子式表示XY2的形成过程__________________。
(2)主族元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻, 则D的离子结构示意图是_________;D与E能形成一种类似于CO2的三原子分子,且每个原子均达到了8e稳定结构,该分子的化学键类型为_________(填“离子键”或“共价键”)。
(3)用化学式回答:
①D与Y的氢化物稳定性________>________;
②D与Y的最高价氧化物对应水化物酸性________>________。
(4)某兴趣小组设计的简易原电池装置如下图所示。回答下列问题:

①锌片为_____极(填“正”或“负”)。
②电池正极的现象是_________________,其电极反应式为_____________________。
③电流由_______经导线流向______(填“锌片”或“碳棒”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+、Mg2+、SO42-可将粗盐溶于水,然后进行下列五项操作:①过滤;②加过量氢氧化钠;③加适量盐酸;④加足量碳酸钠溶液;⑤加过量氯化钡溶液。下列操作顺序正确的是
A. ①④②⑤③ B. ④①②⑤③ C. ④②⑤①③ D. ⑤②④①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)常用作种子及谷物的无毒性消毒剂,常温下为白色的固体,微溶于水,且不溶于乙醇、乙醚和碱性溶液,但溶于酸。
某实验小组拟探究CaO2的性质及其实验室制法。
(1)实验探究CaO2与酸的反应。
操作 | 现象 |
向盛有4 g CaO2的大试管中加入10mL稀盐酸得溶液a | 剧烈反应,产生能使带火星木条复燃的气体 |
取5 mL溶液a于试管中,滴入两滴石蕊试液 | 溶液变红,一段时间后溶液颜色明显变浅,稍后,溶液变为无色 |
①CaO2与盐酸反应的化学方程式为_______________________________。
②加入石蕊试液后溶液褪色可能是因为溶液a中存在较多的_________。
(2)用如图所示装置制备过氧化钙,其反应原理为Ca+O2![]() CaO2。
CaO2。
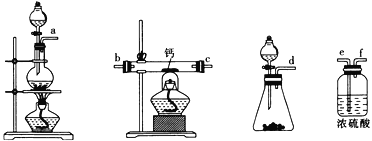
①请选择实验所需要的装置,按气流方向连接的顺序为______________________(填仪器接口的字母,上述装置可不选用也可重复使用)。
②根据完整的实验装置进行实验,实验步骤如下:Ⅰ.检验装置的气密性后,装入药品;Ⅱ.打开分液漏斗活塞,通入气体一段时间,加热药品;Ⅲ.反应结束后,_________________________________(填操作);Ⅳ.拆除装置,取出产物。
(3)利用反应:Ca2++ H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4+在碱性环境下制取CaO2的装置如图所示。

①NH3在Ca2+和H2O2的反应过程中所起的作用是______________________。
②反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。过滤需要的玻璃仪器是_________;将沉淀进行洗涤的操作为_____________________________________________。
(4)设计实验证明CaO2的氧化性比FeCl3的氧化性强:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从海带中提取碘的部分流程如下:
![]()
下列说法不正确的是
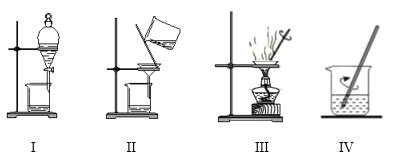
A. 完成步骤①需要装置IIIB. 完成步骤③需要装置II
C. 完成步骤⑤需要装置ID. 完成步骤②和④需要装置IV
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表诞生150周年,元素周期表(律)在学习、研究和生产实践中有很重要的作用。下表为元素周期表的一部分,回答下列问题。
族 周期 | IA | 0 | ||||||
1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ||||||||
(1)元素①~⑧中,金属性最强的是________(填元素符号)。
(2)中国青年化学家姜雪峰被国际组织推选为“元素⑦代言人”,元素⑦的原子结构示意图是________,其氢化物的电子式是_________。
(3)元素①和②可以形成多种化合物。下图模型表示的分子中,不可能由①和②形成的是_______(填序号)。
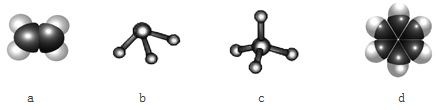
(4)比较元素②、③的最高价氧化物对应水化物的酸性:______>______(填化学式)。说明你判断的理由:_________。
(5)主族元素砷(As)的部分信息如图所示。
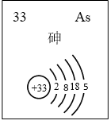
i.砷(As)在周期表中的位置是______。
ii.下列说法正确的是_______(填序号)。
a. 砷元素的最高化合价为+4
b. 推测砷有多种氧化物
c. ③的气态氢化物的还原性大于砷的气态氢化物的还原性
(6)某小组同学设计实验比较VIIA元素的非金属性:Cl>Br>I。
已知:常温下浓盐酸与高锰酸钾反应生成氯气。
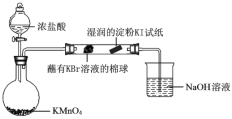
打开分液漏斗的活塞,烧瓶中产生黄绿色气体,蘸有KBr溶液的棉球变为橙红色,湿润的淀粉KI试纸变蓝,据此现象能否说明非金属性:Br > I,并说明理由_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com