
【题目】二氧化硫是危害最为严重的大气污染物之一,它主要来自化石燃料的燃烧,研究CO催化还原SO2的适宜条件,在燃煤电厂的烟气脱硫中具有重要价值。
Ⅰ.从热力学角度研究反应
(1)C(s)+O2(g)= CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)=2CO(g) ΔH2=+172.5kJ·mol-1
S(s) +O2(g)= SO2(g) ΔH3=-296.0kJ·mol-1
请写出CO 还原SO2的热化学方程式___________________________________。
(2)对于CO还原SO2的可逆反应,下列说法正确的是_____________。
A.在恒温恒容条件下,若反应体系压强不变,则反应已达到平衡状态
B.平衡状态时,2v正(CO)=v逆(SO2)
C.其他条件不变,增加SO2的浓度,CO的平衡转化率增大
D.在恒温恒压的容器中,向达到平衡状态的体系中充入N2,SO2的平衡转化率不变
Ⅱ.探究合适的反应条件
向反应器中通入含3%SO2、6%CO和91%N2的烟气,用碘量法测定反应前后烟气中SO2的含量,反应温度区间均为300℃~500℃。
(1)催化剂和温度对反应的影响
烟气流量为0.03 L/min,分别在3种不同催化剂条件下进行实验,实验结果如下图所示。
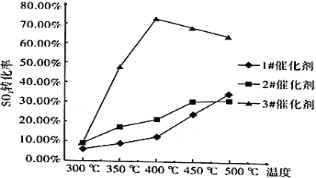
根据上图示结果,烟气除硫时选用最合适催化剂是_____________,反应温度是_______________。
(2)烟气流速对反应的影响
选用同样的催化剂,分别在三种烟气流量情况下进行实验,实验结果的数据见下表。
温度(℃) | 300 | 400 | 500 | |
SO2转化率 | 流量0.03 L/min | 25.00% | 71.40% | 65.00% |
流量 0.06 L/min | 20% | 74.20% | 62.60% | |
流量0.09 L/min | 18% | 76.30% | 60% | |
分析上表数据,①在300℃时,SO2的转化率随烟气流量变化的关系是______________,其原因可能是____________;②在400℃时,SO2的转化率随烟气流量增大而增大的原因是___________________。
Ⅲ.工业上还用Na2SO3溶液吸收SO2,将烟气通入1.0 mol·L-1的Na2SO3溶液,当溶液pH约为6 时,吸收SO2的能力显著下降,此时溶液中c(HSO3-)∶(SO32-)=____________。(已知H2SO3的K1
【答案】 2CO(g)+SO2(g)==2CO2(g)+S(s) ΔH=-270.0kJ·mol-1 AC 3#催化剂 400℃ 烟气流量越大,SO2的转化率越小 300℃时,催化剂活性不好,反应速率慢,烟气流速越小,气体和催化剂接触时间越长,SO2转化率越高 400℃时,催化剂活性好,反应速率快,烟气流速越大,反应物浓度越大,反应正向进行越彻底,SO2 转化率越高 10
【解析】I. (1). 已知 ① C(s)+O2(g)= CO2(g) ΔH1=-393.5 kJ·mol-1、② CO2(g)+C(s)=2CO(g) ΔH2=+172.5kJ·mol-1、③ S(s) +O2(g)= SO2(g) ΔH3=-296.0kJ·mol-1,根据盖斯定律,①-②-③得:2CO(g)+SO2(g)=2CO2(g)+S(s) ΔH=-270.0kJ·mol-1,故答案为:2CO(g)+SO2(g)=2CO2(g)+S(s) ΔH=-270.0kJ·mol-1;
(2). A. 2CO(g)+SO2(g)=2CO2(g)+S(s)是反应前后气体体积不相等的可逆反应,在恒温恒容条件下,若反应体系压强不变,说明反应达到平衡状态,故A正确;B. 达到平衡状态时,v正(CO)=2v逆(SO2),故B错误;C. 增大SO2的浓度,平衡正向移动,CO的转化率增大,故C正确;D. 在恒温恒压的容器中,向达到平衡状态的体系中充入N2,容器的体积增大,相当于减小压强,平衡逆向移动,SO2的平衡转化率减小,故D错误;答案选:AC;
II. (1). 据图可知,使用3#催化剂、在400℃时,SO2的转化率最大,故答案为:3#催化剂;400℃;
(2). ①.由表中数据可知,在300℃时,烟气的流量越大,SO2的转化率越小,结合图象可知,在300℃时,催化剂的催化活性较低,所以在此温度下反应速率慢,烟气的流速越小,气体和催化剂接触的时间越长,SO2的转化率越高,故答案为:烟气流量越大,SO2的转化率越小;300℃时,催化剂活性不好,反应速率慢,烟气流速越小,气体和催化剂接触时间越长,SO2转化率越高;
②. 据图可知,在400℃时,催化剂活性最好,此温度下反应速率最快,烟气流速越大,反应物浓度越大,反应正向进行越彻底,SO2的转化率越高,故答案为:400℃时,催化剂活性好,反应速率快,烟气流速越大,反应物浓度越大,反应正向进行越彻底,SO2 转化率越高;
III. 溶液pH=6,c(H+)=10-6mol/L,H2SO3的二级电离常数K2=![]() =1.0×10-7,
=1.0×10-7,![]() =
=![]() =
=![]() =10,故答案为:10。
=10,故答案为:10。


科目:高中化学 来源: 题型:
【题目】根据如图转化关系判断下列说法不正确的是(反应条件已略去)
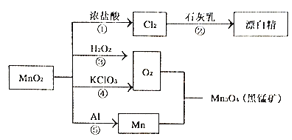
A. 反应①②③④⑤均属于氧化还原反应
B. 生成黑锰矿的反应中,3molMn参加反应转移4mol电子
C. 生成等量的O2,反应③和④转移的电子数之比为1:2
D. 反应⑤为铝热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol由两种气态烃组成的混合气体完全燃烧后,得到0.16mol CO2和3.6克水,则混合气体中( )
A. 一定有甲烷
B. 一定是甲烷和乙烯
C. 可能有乙烷
D. 一定有乙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个容积相同的容器中,一个盛有HCl气体,另—个盛有H2和Cl2的混合气体。在同温同压下, 两容器内的气体一定具有相同的( )
A. 原子数 B. 密度 C. 质量 D. 质子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是SO2制取、性质检验、收集、尾气处理的装置,有关说法正确的是
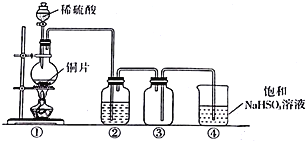
A. 上图中有两处错误
B. 装置①也可以用于制取氨气、氯气
C. 在②中加入品红或紫色石蕊试液都可以验证SO2的漂白性
D. 在②中加入BaCl2溶液,先生成白色沉淀,随后沉淀慢慢消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L0.1mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下Kb(NH3·H2O)=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如下图所示。下列叙述正确的是( )

A. 0.1mol·L-1HR溶液的pH约为5 B. HR为弱酸,常温时Ka(HR)=1.0×10-7
C. 当通入0.1molNH3时,溶液中c(R-)<c(NH4+) D. 当c(HR)=c(R-)时,溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某硫酸试剂瓶的标签上的部分文字。据此,下列说法正确的是

A. 该试剂中加入适量蒸馏水可以获得较稀的硫酸溶液
B. 该试剂瓶的标签上应印有如图所示的警示标记

C. 该硫酸与等体积水混合所得溶液的物质的量浓度等于9.2mol/L
D. 在50mL量筒中配制0.1000mol/L硫酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g)ΔH<0,下列研究目的和示意图相符的是( )
2NH3(g)ΔH<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响(p2>p1) | 温度对反应的影响 | 平衡体系中增加N2浓度对反应的影响 | 催化剂对反应的影响 |
示意图 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.氯化钠中混有少量单质碘杂质,可用升华的方法提纯
B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
C.SO2可使酸性高锰酸钾溶液褪色,体现了SO2的漂白性
D.浓硫酸具有吸水性,可以用作干燥剂,例如可用于NH3的干燥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com