
| X值 | 残留固体 | |
| 化学式 | 物质的量 | |
| ||
| ||
| ||
| ||
| 1 |
| 2 |
| 2 |
| 3 |
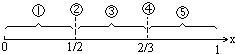
| 1 |
| 2 |
| ||
| 1 |
| 2 |
| ||
| 1 |
| 2 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| X值 | 残留固体 | |||||
| 化学式 | 物质的量 | |||||
0<x<
|
C、Cu | A(1-2x)、Ax | ||||
|
Cu | Ax | ||||
|
Cu、CuO | 2A(1-x)、A(3x-2) | ||||


 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:

| A、乙烧杯中d的电极反应为 2Cl--2e-=Cl2↑ | ||||
| B、a、c两极产生气体的物质的量相等 | ||||
C、乙烧杯中发生的反应为2NaCl+2H2O
| ||||
| D、甲、乙两烧杯中溶液的pH均保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HClO中氯元素化合价比HClO4中氯元素化合价低,所以HClO4的氧化性强 |
| B、已知①Fe+Cu2+═Fe2++Cu;②2Fe3++Cu═2Fe2++Cu2+,则氧化性强弱顺序为:Fe3+>Cu2+>Fe2+ |
| C、已知还原性:B->C->D-,反应 2C-+D2═2D-+C2和反应2C-+B2═2B-+C2都能发生 |
| D、具有强氧化性和强还原性的物质放在一起就能发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ClO2 |
| 反应Ⅰ |
| Na2SO3水溶液 |
| 反应Ⅱ |
c(S
| ||
c(HS
|
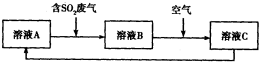
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去碳酸氢铵粉末中混有的I2:加热使I2升华 |
| B、蒸发结晶时,加热至混合物中的水分完全蒸干 |
| C、过滤时倒入漏斗的过滤液的液面应低于滤纸边缘 |
| D、除去碳酸钠中混有的碳酸氢钠:加入过量的氢氧化钠溶液,蒸发结晶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com