
【题目】试写出下列反应的离子方程式。
(1)氯化亚铁溶液中加入稀硝酸:______________________________________。
(2)氯化亚铁溶液中加入过氧化氢:________________________________。
(3)用酸性KMnO4标准溶液滴定莫尔盐[FeSO4(NH4)2SO4·xH2O]溶液:___________________________。
(4)硫酸亚铁溶液中加入次氯酸钠溶液:_____________________________。
(5)用酸性重铬酸钾(K2Cr2O7)溶液滴定硫酸亚铁溶液:_________________________。
【答案】3Fe2++4H++NO3-=3Fe3++NO↑+2H2O 2Fe2++2H++H2O2=2Fe3++2H2O ![]()
![]()
![]()
【解析】
(1`)亚铁离子被氧化产生铁离子,同时产生一氧化氮和水,根据电荷守恒以及质量守恒即可配平离子方程式;
(2)在酸性条件下H2O2将Fe2+氧化为Fe3+,H2O2被还原产生H2O;
(3)用酸性KMnO4标准溶液滴定莫尔盐,亚铁离子被氧化产生铁离子,MnO4-被还原产生Mn2+;
(4)亚铁离子被氧化产生铁离子,ClO-被还原产生Cl-,同时产生H2O;
(1)Fe2+失去电子变为Fe3+,元素化合价升高1价,NO3-得到电子变为NO,元素化合价由+5降低到+2,降低3价,升降最小公倍数是3,所以Fe2+、Fe3+系数是3,NO3-、NO系数是1,结合电荷守恒,可知H+的系数是4,根据原子守恒,可知H2O的系数是2,方程式为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;
(2)氯化亚铁溶液中加入过氧化氢,Fe2+失去电子变为Fe3+,H2O2被还原产生H2O,反应离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O;
(3)用酸性KMnO4标准溶液滴定莫尔盐,亚铁离子被氧化产生铁离子,MnO4-被还原产生Mn2+,离子方程式为:![]() ;
;
(4)硫酸亚铁溶液中加入次氯酸钠溶液,HClO可以氧化Fe2+生成Fe3+,ClO-被还原产生Cl-,同时产生H2O,离子方程式为:![]() ;
;
(5)用酸性重铬酸钾(K2Cr2O7)溶液滴定硫酸亚铁溶液,重铬酸钾氧化Fe2+生成Fe3+,Cr2O72-被还原产生Cr3+,反应的离子方程式为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列有关糖类油脂及蛋白质的说法正确的是( )
A.相同质量的这三种物质在人体内被完全氧化时,糖类释放的能量最多
B.油脂中的碳链均为碳碳单键时,主要是低沸点的植物油
C.蛋白质仅由碳、氢、氧三种元素组成
D.淀粉、纤维素及蛋白质均能发生水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 晶体的晶胞结构与NaCl晶体的相似
晶体的晶胞结构与NaCl晶体的相似![]() 如图所示
如图所示![]() ,但因为
,但因为![]() 晶体中含有的哑铃形
晶体中含有的哑铃形![]() 的存在,使晶胞沿一个方向拉长。下列关于
的存在,使晶胞沿一个方向拉长。下列关于![]() 晶体的说法中正确的是
晶体的说法中正确的是![]()

A. 1个![]() 周围距离最近且等距离的
周围距离最近且等距离的![]() 数目为4
数目为4
B. 该晶体中的阴离子和O2是等电子体
C. ![]() 克
克![]() 晶体中含阴离子0.2mol
晶体中含阴离子0.2mol
D. 与每个![]() 距离相等且最近的
距离相等且最近的![]() 共有12个
共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol·L1 H2C2O4的pH=1.3)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是
A. H2C2O4有酸性,Ca(OH)2+ H2C2O4![]() CaC2O4↓+2H2O
CaC2O4↓+2H2O
B. 酸性:H2C2O4> H2CO3,NaHCO3+ H2C2O4![]() NaHC2O4+CO2↑+H2O
NaHC2O4+CO2↑+H2O
C. H2C2O4具有还原性,2![]() +5
+5![]() +16H+
+16H+![]() 2Mn2++10CO2↑+ 8H2O
2Mn2++10CO2↑+ 8H2O
D. H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种天然气臭味添加剂的绿色合成方法为:CH3CH2CH=CH2+H2S ![]() CH3CH2CH2CH2SH。下列反应的原子利用率与上述反应相近的是
CH3CH2CH2CH2SH。下列反应的原子利用率与上述反应相近的是
A. 乙烯与水反应制备乙醇
B. 苯和硝酸反应制备硝基苯
C. 乙酸与乙醇反应制备乙酸乙酯
D. 甲烷与Cl2反应制备一氯甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式:__________________________。
(2)H2S燃烧生成的SO2与H2S进一步反应,硫元素转化为S2,写出反应的化学方程式:__________________________。
(3)在酸性条件下,NaHSO3使Cr2O72-还原成为Cr3+,请写出NaHSO3与Cr2O72-反应的离子方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)下列几组物质中,互为同系物的有______________,互为同分异构体的有______________。
①O2和O3
②35Cl和37Cl
③CH3CH3和CH3CH2CH3
④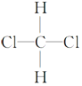 和
和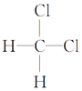
⑤CH3(CH2)2CH3和(CH3)2CHCH3
(2)烷烃A在同温同压下蒸气的密度是H2的43倍,该烃的分子式为______________。分子式为C8Hn的烯烃B中n为______________。
(3)相对分子质量为58的烷烃C的结构有______________种;试分别写出它们的结构简式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有_____种不同运动状态的电子。
(2)如图2所示,每条折线表示周期表ⅣA ~ⅦA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___________。判断依据是____________。
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于_____________晶体。
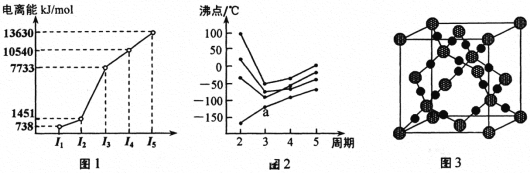
(4)第一电离能介于Al、P之间的第三周期元素有____种。 GaCl3中中心原子的杂化方式为_________,写出与GaCl3结构相同的一种等电子体(写离子)______________。
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性,而干冰、碘的晶体具有相似的结构特征,干冰分子中一个分子周围有__________个紧邻分子。 D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是_____________(填字母标号)。
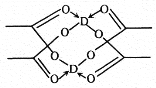
a.极性键 b.非极性键 c.配位键 d.金属键
(6)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A~D图中正确的是_____(填字母标号)。

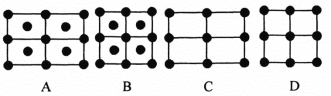
铁原子的配位数是____________,假设铁原子的半径是r cm,该晶体的密度是ρg/cm3 ,则铁的相对原子质量为________________(设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.在1个CsCl晶胞中含有1个Cs+
B.SO2在水中的溶解度比CO2在水中的溶解度要大
C.X、Y元素同周期,且电负性X>Y,第一电离能可能Y大于X
D.根据电子排布的特点,Cu和Ga在周期表中都属于d区
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com