
【题目】常压下羰基化法精炼镍的原理:Ni(s)+4CO(g) ![]() Ni(CO)4(g)。230 ℃时,该反应的平衡常数 K=2×10-5。已知:Ni(CO)4 的沸点为 42.2 ℃,固体杂质不参与反应。
Ni(CO)4(g)。230 ℃时,该反应的平衡常数 K=2×10-5。已知:Ni(CO)4 的沸点为 42.2 ℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至 230 ℃制得高纯镍。下列判断正确的是
A.增加 c(CO),平衡向正向移动,反应的平衡常数增大
B.该反应达到平衡时,![]() 生成[Ni(CO)4])=4
生成[Ni(CO)4])=4![]() 生成(CO)
生成(CO)
C.第一阶段,在 30 ℃和 50 ℃两者之间选择反应温度,选50 ℃
D.第二阶段,Ni(CO)4分解率较低
科目:高中化学 来源: 题型:
【题目】己知:CH4(g)+2H2S(g)![]() CS2(g)+4H2(g)。向恒容密闭容器中充入0.lmolCH4 和0.2molH2S,下图所示:
CS2(g)+4H2(g)。向恒容密闭容器中充入0.lmolCH4 和0.2molH2S,下图所示:

下列说法正确的是
A. 该反应的△H<O
B. X 点CH4的转化率为20%
C. X点与Y点容器内压强比为55:51
D. 维持Z点温度,向容器中再充入CH4、H2S、CS2、H2 各0.1mol 时V(正)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物键线式结构的特点是以线示键,每个折点和线端点处表示有一个碳原子,并以氢补足四价,C、H不表示出来。降冰片烷立体结构如图所示:
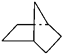
(1)写出其分子式____________。
(2)当降冰片烷发生一氯取代时,能生成_____________种沸点不同的产物。
(3)根据降冰片烷的键线式结构,请你判断:降冰片烷属于______________________。
a.环烷烃 b.饱和烃 c.不饱和烃 d.芳香烃
(4)降冰片烷具有的性质是__________________。
a.能溶于水 b.能燃烧 c.能使酸性高锰酸钾溶液褪色
d.能发生加成反应 e. 能发生取代反应 f. 常温常压下为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在4个体积均为 1.0 L的恒容密闭容器中反应2SO2(g)+O2 (g)![]() 2SO3(g) 达到平衡。
2SO3(g) 达到平衡。
下列说法正确的是
容器 | 温度/K | 物质的起始浓度/moI/L | 物质的平衡浓度moI/L | O2或SO3平衡转化率 | ||
c(SO2) | c(O2) | c(SO3) | c(SO3) | |||
Ⅰ | 723 | 0.2 | 0.2 | 0 | 0.04 | α1 |
Ⅱ | 723 | 0 | 0.1 | 0.2 | α2 | |
Ⅲ | 723 | 0.4 | 0.4 | 0 | α3 | |
IV | 823 | 0 | 0.1 | 0.2 | α4 | |
A. 达到平衡时, α1+α2=1
B. 达到平衡时,容器中的压强:PⅠ>PIV
C. 达到平衡时,逆反应速率容器IV中比容器Ⅰ中的大
D. 达平衡后,再向容器Ⅰ中充入0.16 mol SO2、0.04 mol SO3,则此时反应向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能应用化学平衡移动原理来解释的是
①可用浓氨水和NaOH固体快速制氨气 ②700K左右比室温更有利于合成氨反应
③开启啤酒瓶后,瓶中马上泛起大量泡沫 ④温度升高水的KW增大
⑤对于反应2HI(g) ![]() H2(g)+I2(g)达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g)达平衡后,缩小容器体积可使体系颜色变深
A. ①②③ B. ②④⑤ C. ②⑤ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的实验,能达到实验目的的是
A | B | C | D |
|
|
片刻后在 Fe 电极附近滴入铁氰化钾溶液 |
|
验证化学能转化为电能 | 证明温度对平衡移动的影响 | 验证 Fe 电极被保护 | 验证AgCl 溶解度大于Ag2S |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,用石墨电极电解饱和食盐水。下列说法不正确的是( )
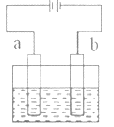
A.通电使NaCl 发生电离
B.电极a 是阳极
C.Na+向 b 极移动
D.a 极产生黄绿色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的叙述中正确的是
A.用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的
B.汽油、柴油、花生油都是多种碳氢化合物的混合物
C.有机物![]() 1mol最多可与3 mol H2发生加成反应
1mol最多可与3 mol H2发生加成反应
D.分子式为C15H16O2的同分异构体中不可能含有两个苯环结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】缓冲和供氧是维持人体正常生理活动的两个重要平衡系统,回答下列问题:
Ⅰ.人体血液中存在平衡:H2CO3 (aq)![]() H+(aq)+HCO3-(aq) △H,该平衡可使血液的pH维持在一定范围内。
H+(aq)+HCO3-(aq) △H,该平衡可使血液的pH维持在一定范围内。
(1)已知:
CO2(g)![]() CO2(aq) △H1=akJ·mol-l;
CO2(aq) △H1=akJ·mol-l;
CO2(aq)+H2O(l)![]() H2CO3 (aq) △H2=bkJ mol-1;
H2CO3 (aq) △H2=bkJ mol-1;
HCO3-(aq)![]() H+(aq)+CO32-(aq) △H3=ckJ mol-1;
H+(aq)+CO32-(aq) △H3=ckJ mol-1;
CO2(g)+H2O(l)![]() 2H+(aq)+CO32-(aq) △H4=dkJ mol-1。
2H+(aq)+CO32-(aq) △H4=dkJ mol-1。
则上述电离方程式中△H =_____________(用含a、b、c、d的代数式表示)。
(2)若某人血液中c(HCO3-):c(H2CO3)=20:1,pKa1(H2CO3)=6.1,则该人血液的pH=_____________,pH升高,则![]() ___(填“增大”“减小”或“不变”)。
___(填“增大”“减小”或“不变”)。
(3)当有少量酸性物质进入血液后,血液的pH变化不大,用平衡移动原理解释上述现象:_____________。
Ⅱ.肌细胞石储存氧气和分配氧气时存在如下平衡:
Mb(aq)+O2(g)![]() MbO2(aq)。
MbO2(aq)。
肌红蛋白 氧合肌红蛋白
(4)经测定动物体温升高,氧气的结合度[α(MbO2),氧合肌红蛋白的浓度占肌红蛋白初始浓度的百分数]降低,则该反应的△H_______________(填“>”或“<”)0。
(5)温度为37 ℃时,氧气的结合度[α(MbO2)与氧气的平衡分压[p(O2)]关系如下图所示:
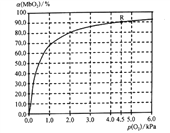
①利用R点所示数据,计算37 ℃时该反应的平衡常数K=_________________(氧气的平衡浓度可用氧气的平衡分压代替求算)。
②已知37 ℃时,该反应的正反应速率v(正)=k1c(Mb)×p(O2),逆反应速率v(逆)=k2c(MbO2),若k2=60s-1,则k1=___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com