
【题目】一定条件下,某容器中各微粒在反应前后变化示意图如图,其中“o”和“”代表不同元素的原子.下列关于此反应的说法不正确的是( )

A.该反应可表示为![]()
B.可能是PCl5的分解反应
C.反应过程中,一定伴随共价键的断裂与形成
D.该反应一定是吸热反应
科目:高中化学 来源: 题型:
【题目】A、B、C、D是中学化学中常见的四种物质,且A、B、C中含有同一种元素,其转化关系如图所示。下列说法正确的是( )
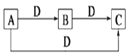
A. 若B为一种两性氢氧化物,则D可能是强酸,也可能是强碱
B. 若A为固态非金属单质,D为O2,则A可以为单质硫
C. 若A为强碱,D为CO2,则B的溶解度一定大于C的溶解度
D. 若A为18电子气态氢化物,D为O2,则A只能是C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镧系为元素周期表中第ⅢB族、原子序数为57~71的元素。
(1)镝(Dy)的基态原子电子排布式为[Xe]4f106s2,画出镝(Dy)原子外围电子排布图:___________。
(2)高温超导材料镧钡铜氧化物中含有Cu3+,基态时Cu3+ 的电子排布式为________________。
(3)观察下面四种镧系元素的电离能数据,判断最有可能显示+3 价的元素是___________(填元素名称)。几种镧系元素的电离能(单位:kJ mol-1)
元素 | I1 | I2 | I3 | I4 |
Yb(镱) | 604 | 1217 | 4494 | 5014 |
Lu(镥) | 532 | 1390 | 4111 | 4987 |
La(镧) | 538 | 1067 | 1850 | 5419 |
Ce(铈) | 527 | 1047 | 1949 | 3547 |
(4)元素铈(Ce)可以形成配合物(NH4)2[Ce(NO3)6]。
①组成配合物的四种元素,电负性由大到小的顺序为________________(用元素符号表示)。
②写出氮的最简单气态氢化物水溶液中存在的氢键:__________________(任写一种)。
③元素Al 也有类似成键情况,气态氯化铝分子表示为(AlCl3)2,分子中Al 原子杂化方式为_____________,分子中所含化学键类型有______________(填字母)。
a.离子键 b.极性键 C.非极性键 d.配位键
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中镨原子位于面心和顶点,则PrO2(二氧化镨)的晶胞中有________个氧原子;已知晶胞参数为a pm,密度为ρ g· cm-3,NA=_____________ (用含a、ρ的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的是( )


A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于以下反应:A(s)+3B(g)![]() 2C(g)+D(g),在一定温度、压强下,在一体积可变的容器中,当下列物理量不再发生变化时就可确定反应一定达到平衡状态的是
2C(g)+D(g),在一定温度、压强下,在一体积可变的容器中,当下列物理量不再发生变化时就可确定反应一定达到平衡状态的是
A.容器的体积不再发生变化
B.B的生成速率和D的反应速率之比为3∶1
C.混合气体的密度不随时间变化
D.B、C、D的分子个数之比为3∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下Ksp(AgCl)=1.6×10-10、Ksp(AgI)=2.0×10-16,下列说法中正确的是
A.含有大量Cl-的溶液中肯定不存在Ag+
B.AgI悬浊液中加入少量KI粉末,平衡AgI(s)![]() Ag+(aq)+I-(aq)向左移动,溶液中离子的总浓度会减小
Ag+(aq)+I-(aq)向左移动,溶液中离子的总浓度会减小
C.AgCl悬浊液中逐渐加入KI固体至c(I-)=Ksp(AgI)/Ksp(AgCl)mol·L-1时,AgCl开始向AgI沉淀转化
D.向浓度均为0.01 mol·L-1的KCl和KI的混合溶液中滴加AgNO3溶液,当Cl-开始沉淀时,溶液中I-的浓度为1.25×10-8 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料可生产草酸锌晶体(ZnC2O4·2H2O)。
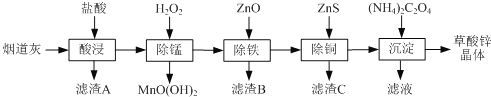
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 4.2 | 5.4 |
沉淀完全的pH | 3.3 | 9.7 | 6.7 | 8.2 |
请问答下列问题:
(1)滤渣B的主要成分为________ 。
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为________。
(3)①除铁(部分Cu2+可能被除去)时加入ZnO控制反应液pH的范围为___________。
②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是________。
(4)若沉淀过程采用Na2C2O4代替草酸铵晶体生产草酸锌,合理的加料方式是________。
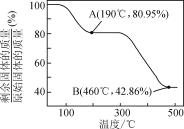
(5)将草酸锌晶体加热分解可得到一种纳米材料。加热过程中固体残留率随温度的变化如图所示,300 ℃~460 ℃范围内,发生反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的分类,乙醛(CH3CHO)属于醛。下面各项对有机物的分类方法与此方法相同的是
①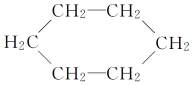 属于环状化合物
属于环状化合物
②![]() 属于卤代烃
属于卤代烃
③![]() 属于链状化合物
属于链状化合物
④ 属于醚
属于醚
A. ①② B. ②③ C. ②④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电-Fenton法是用于水体中有机污染物降解的高级氧化技术,其反应原理如图所示。其中电解产生的H2O2与Fe2+发生Fenton反应:H2O2+Fe2+=Fe3++OH-+·OH,生成的羟基自由基(·OH)能氧化降解有机污染物。下列说法中正确的是

A.电源的X极为正极,Y极为负极
B.阴极的电极反应式为Fe2+-e-=Fe3+
C.阳极的电极反应式为H2O-e-=H++·OH
D.每消耗1molO2,整个电解池中理论上可产生2mol·OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com