
【题目】现有一瓶含NaCl杂质的Na2CO3样品,某同学设计了一种测定其纯度的方法,装置如下图,其中A容器中盛有样品10.0 g,分液漏斗内盛有稀硫酸,B容器内为碱石灰固体。
(1)该同学重复操作了三次,每次操作均正确,且装置不漏气,可是结果数据出现了较大偏差(容器内反应均完全,装置内空气的影响忽略不计),请你分析可能的原因______。


(2)通过仔细分析,该同学重新设计了一套实验装置如下图,请回答有关问题:
(可供选择的试剂还有Zn片、浓硫酸、NaOH溶液、CaCO3固体、蒸馏水)
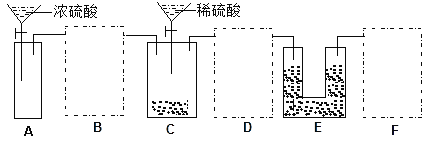
①该套装置未画完整,请在你认为需要补充装置的虚框内画出合适的简图,并注明试剂。______
②A装置的广口瓶中应加入的试剂是__________;该装置的作用是________________。
③如果实验后测得E装置质量增重3.52 g,则该Na2CO3试样的纯度为__________。
(3)测定该Na2CO3试样纯度的方法有多种,请你利用不同的反应原理再设计一套方案。
要求写出实验操作流程和试样中Na2CO3纯度的表达式__________。(试剂任选)
操作流程按下列图示表述:
![]()
①操作流程为:
![]()
②实验时称量样品的质量为a克,所测物质的质量为b克,该试样中Na2CO3纯度的表达式为:__________。
【答案】 A中产生的CO2气体未全部进入B;CO2中混有的少量水蒸气进入B;B吸收了空气中的水蒸气、CO2。 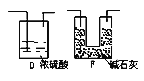 Zn片和蒸馏水 利用A中生成的H2 将C中的CO2全部排入E中被碱石灰吸收 84.8%
Zn片和蒸馏水 利用A中生成的H2 将C中的CO2全部排入E中被碱石灰吸收 84.8% 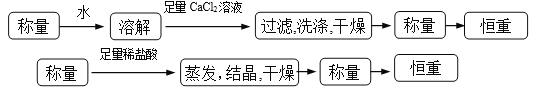 53b/50a 或106(b-a)/11a
53b/50a 或106(b-a)/11a
【解析】(1)该同学重复操作了三次,每次操作均正确,且装置不漏气,排除了偶然误差的可能,可是结果数据出现了较大偏差,说明实验方案的设计有缺陷。首先分析A装置,发现没有将其中产生的CO2气体全部排出进入B的措施;再分析A中产生的CO2,其中肯定会混有的少量水蒸气随CO2进入B被碱石灰一起吸收;B吸收了空气中的水蒸气、CO2。
(2).针对上面分析的设计缺陷,根据所提供的药品和试剂,可以先用硫酸和锌制取氢气通入C装置,将C装置产生的二氧化碳全部排出经盛有浓硫酸的洗气瓶D装置干燥后再通入E被碱石灰吸收,为防止E吸收空气中的二氧化碳和水蒸气,在E后面加装一个和E相同的装置F,①图示如下:
②A装置是制取氢气用的,实验室通常用锌和稀硫酸反应制氢气,所以广口瓶中应加入的试剂是Zn片和蒸馏水;该装置的作用是利用A中生成的H2 将C中的CO2全部排入E中被碱石灰吸收。
③如果实验后测得E装置质量增重3.52 g,则二氧化碳的质量为3.52 g,其物质的量为0.08mol,因为反应前后碳原子守恒可知样品中碳酸钠的物质的量是0.08mol,所以该Na2CO3试样的纯度为![]()
![]() =84.8% 。
=84.8% 。
(3). 方案一:可以称量样品质量a g,加水将其充分溶解后,向所得水溶液中加入稍过量的氯化钙溶液,过滤,用少量蒸馏水洗涤沉淀2~3次,再将碳酸钙沉淀干燥后称重。方案二:可以称量样品质量a g,加足量稀盐酸将样品充分溶解后,将溶液蒸发结晶得到氯化钠晶体,晶体经干燥后称重。①流程如下: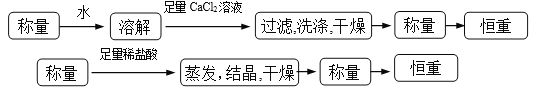 (4). ②方案一:由沉淀碳酸钙的质量b g可求出碳酸钠的物质的量为
(4). ②方案一:由沉淀碳酸钙的质量b g可求出碳酸钠的物质的量为![]() mol,碳酸钠的质量为 53b/50g,所以碳酸钠的质量分数为53b/50a 。
mol,碳酸钠的质量为 53b/50g,所以碳酸钠的质量分数为53b/50a 。
方案二: Na2CO3 ~ 2NaCl ~ △m
106 117 11
m (b-a)g
列比例式求出m=106(b-a)/11 g
所以碳酸钠的质量分数为106(b-a)/11a


科目:高中化学 来源: 题型:
【题目】(1)现有如下两个反应:(A)NaOH + HCl = NaCl + H2O (B)2FeCl3 + Cu = 2FeCl2 + CuCl2
①根据两反应本质,判断能否设计成原电池 。
②如果不能,说明其原因 。
(2)选择适宜的材料和试剂设计一个原电池,以便完成下列反应:Zn + CuSO4 = ZnSO4 + Cu
①画出装置图并标明名称;②写出电极反应式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两种气态烃组成混合气体2.24L,完全燃烧后,得到3.36LCO2和3.6g水,则关于该混合烃的组成判断正确的是
A. 可能含甲烷 B. 一定含乙烷
C. 一定是甲烷和乙烯的混合气体 D. 可能是甲烷和丙炔的混合气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用![]() +
+![]() → H2O表示的是
→ H2O表示的是
A. NaHSO4 + NaOH → Na2SO4 + H2O B. CH3COOH + NaOH → CH3COONa + H2O
C. H2SO4 + Ba(OH)2 → BaSO4↓ + 2H2O D. NH3 · H2O + HCl → NH4Cl + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】宋代著名法医学家宋慈的《洗冤集录》中有一银针验毒的记载,“银针验毒”的原理是4Ag + 2H2S + O2 =" 2X" + 2H2O,下列说法正确的是
A. X的化学式为AgS B. 银针验毒时,空气中氧气失去电子
C. 反应中Ag和H2S均是还原剂 D. 每生成1mo1X,反应转移2mo1e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 电解质的电离是在通电的条件下进行的
B. 强电解质溶液的导电能力不一定比弱电解质溶液强
C. 盐酸是强电解质,所以盐酸中没有HCl分子
D. H2O(g)==H2O(l)是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属的工业制法中,正确的是:
A. 以海水为原料制得精盐,再电解精盐的水溶液制取钠
B. 用海水、石灰乳等为原料,经一系列过程制得氧化镁,用H2还原氧化镁制得镁
C. 以铁矿石、焦炭、空气、石灰石等为原料,通过反应产生的CO在高温下还原铁矿石制得铁
D. 从铝土矿中获得氧化铝再制得氯化铝固体,电解熔融的氯化铝得到铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸钠可以用于制备火箭推进剂高氯酸铵。以粗盐为原料制备高氯酸钠晶体(NaClO4·H2O)的流程如下:

(1)“精制”中,由粗盐(含Ca2+、Mg2+、SO42-等杂质)制备精制盐水时需用到NaOH、BaCl2、Na2CO3等试剂。加入Na2CO3溶液的作用
(2)“电解”分2步进行,其反应分别为NaCl+3H2O![]() NaClO3+3H2↑ NaClO3+H2O
NaClO3+3H2↑ NaClO3+H2O![]() NaClO4+H2↑
NaClO4+H2↑
(3)“除杂”的目的是除去少量未被电解的NaClO3,该反应的化学方程式为: ,
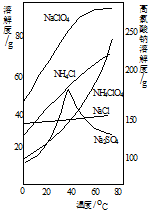
(4)“分离”的操作分别是加热浓缩、 、冷却结晶、过滤、洗涤、干燥。(各物质的溶解度如右图所示)
(5)室温下将得到的高氯酸钠晶体加入氯化铵饱和溶液中,反应的离子方程式为:
(6)为确定所得高氯酸钠晶体的纯度(含有少量Na2SO4杂质),进行如下实验:
①准确称取3.00 g样品加水充分溶解,所得溶液转移至容量瓶并配置成100 mL溶液。
②量取25.00 mL溶液,加入足量的KI溶液充分反应(ClO4-被还原成Cl-),再滴加1.000 mol·L-1 Na2S2O3溶液进行反应(反应为I2+2 Na2S2O3=2 NaI+ Na2S4O6),恰好消耗40.00 mL Na2S2O3溶液。
根据以上数据计算样品中高氯酸钠晶体纯度为: (写出计算过程,保留四位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组反应中关于能量的比较正确的是( )
①H2(g)+Cl2(g)=2HCl(g)△H1; ![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl (g)△H2;△H1>△H2
Cl2(g)=HCl (g)△H2;△H1>△H2
②2H2O(l)=2H2(g)+O2(g)△H1; 2Na(s)+2H2O(l)=2NaOH(aq)+H2(g)△H2;△H1>△H2
③CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l)△H1;CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H1;CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(g)△H2;△H1<△H2
O2(g)=CO2(g)+2H2O(g)△H2;△H1<△H2
④t℃时,在一定条件下,将 1mol N2和 3mol H2 分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为 Q1、Q2; Q1<Q2.
A. ①③④ B. ①②④ C. ②③④ D. ①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com